- Palladium(IV)-oxid
-
Kristallstruktur 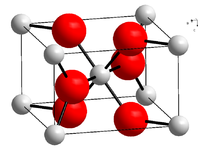
__ Pd4+ __ O2− Allgemeines Name Palladium(IV)-oxid Andere Namen Palladiumdioxid
Verhältnisformel PdO2 CAS-Nummer 12036-04-3 Kurzbeschreibung - dunkelroter Feststoff (Hydrat)
- schwarzer Feststoff (Reinsubstanz)
Eigenschaften Molare Masse 138,419 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit in Wasser, Säuren und Laugen unlöslich [2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Palladium(IV)-oxid, auch als Palladiumdioxid bezeichnet, ist eine chemische Verbindung der Elemente Palladium und Sauerstoff. Es ist als Hydrat ein dunkelrotes, als Reinsubstanz ein schwarzes Salz, das bei 200 °C in Palladium(II)-oxid zerfällt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Palladium(IV)-oxid fällt als Niederschlag beim Versetzen von PdCl62--haltigen wässrigen Lösungen mit verdünnter Natronlauge an[2][4]:
Eine Lösung von Natriumcarbonat enthält ausreichend Hydroxidionen und kann anstatt von Natronlauge verwendet werden:
Eine weitere Synthesemethode ist die anodische Oxidation von Palladium(II)-nitrat.[4] Die Herstellung durch Oxidation von Palladium(II)-chlorid mit Ozon verläuft mit schlechten Ausbeuten, da das Palladiumdioxid mit der als Nebenprodukt anfallenden Salzsäure teilweise weiterreagiert.[4]
Eigenschaften
Physikalische Eigenschaften
Palladiumdioxid kristallisiert im tetragonalen Kristallsystem in der Raumgruppe P42/mnm mit den Gitterparametern a = 448 pm und c = 310 pm sowie zwei Formeleinheiten pro Elementarzelle (Rutilstruktur).[5]
Chemische Eigenschaften
Beim Erhitzen gibt Palladiumdioxid Sauerstoff ab und geht bei 200 °C in Palladium(II)-oxid über, das wiederum bei 875 °C in die Elemente zerfällt.[6]
Das Hydrat löst sich in konzentrierter Natriumhydroxidlösung unter Bildung von Hexahydroxopalladat-Ionen, die wasserfreie Substanz ist in Alkalien unlöslich.[6]
Ebenso ist das Hydrat des Palladiumdioxids in Salzsäure löslich, dabei werden Hexachlorpalladat(IV)-Ionen gebildet.[6]
Palladiumdioxid ist in Oxalsäure zunächst unter Gelbfärbung und Bildung von Dioxalatopalladat(II)-Ionen [Pd(OOC-COO)2]2- löslich[7][4], beim Kochen wird es zu elementarem Palladium reduziert.
Auch beim Kochen mit Essigsäure entsteht elementares Palladium.[4]
Einzelnachweise
- ↑ Palladium(IV)-oxid auf webelements.com
- ↑ a b Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1732.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d e Lothar Wöhler, James König: "Die Oxyde des Palladiums" in Zeitschr. f. Anorg. Chem. 1905, 47, S. 323ff. Volltext
- ↑ I. S. Shaplygin, G. L. Aparnikov, V. B. Lazarev: Preparation of palladium dioxide at high pressure. In: Zhurnal Neorganicheskoi Khimii. 1978, 23, 4, S. 884-7.
- ↑ a b c E. Wiberg, N. Wiberg, A. Holleman: Inorganic Chemistry. 101. Auflage, Academic Press, 2001, ISBN 978-0-1235-2651-9, S. 1520f. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ M. M. Vezes: "Sur les sels complexes de palladium: palladoxalate" in Bull. Soc. Chim. 1899, (3)21, S. 172f. Volltext
Wikimedia Foundation.



![\mathrm{ 2\ PdO_2 \ \ \xrightarrow[-O_2]{200^\circ C} \ \ 2\ PdO \ \ \xrightarrow[-O_2]{875^\circ C} \ \ 2\ Pd}](4/974afe5d8c6caf23588eb0680823d667.png)
![\mathrm{ PdO_2 + 2\ NaOH + 2\ H_2O \longrightarrow Na_2[Pd(OH)_6]}](c/9ec5824e36d59279bf121bdfb7b27b12.png)
![\mathrm{ PdO_2 + 6\ HCl \longrightarrow H_2[PdCl_6] + 2\ H_2O}](f/04f68fa6953a486e17fce232bb050cf6.png)
