- Chiraphos
-
Strukturformel 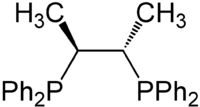
Allgemeines Name Chiraphos Andere Namen - (2S,3S)-(–)-Bis(diphenylphosphino)butan
- (2R,3R)-(+)-Bis(diphenylphosphino)butan
Summenformel C28H28P2 CAS-Nummer - 74839-84-2 (R,R-Enantiomer)
- 64896-28-2 (S, S-Enantiomer)
Kurzbeschreibung weißes, körniges Pulver[1]
Eigenschaften Molare Masse 426,47 g·mol−1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37/39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chiraphos ist ein chiraler zweizähniger Chelatligand. Er gehört zur Gruppe der bidentaten chiralen Phosphinliganden. Der Name setzt sich aus den Worten chiral und phosphino zusammen.
Inhaltsverzeichnis
Darstellung
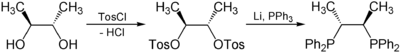
Chiraphos kann enantiomerenrein aus kommerziell enantiomerenrein erhältlicher Weinsäure hergestellt werden. Hierzu werden zunächst die Carboxygruppen der Weinsäure zu Methylgruppen reduziert, wodurch chirales 2,3-Butandiol entsteht. Anschließend werden die Hydroxylgruppen mit p-Toluolsulfonsäurechlorid (=Tos) tosyliert, wodurch sie nun als Abgangsgruppen fungieren können. Im letzten Schritt wird mit elementarem Lithium und Triphenylphosphan die Tosylfunktionen mittels nukleophiler Substitution durch Diphenylphosphino-Gruppen ausgetauscht (Ph=Phenyl).[3]
Eigenschaften
Bei (S,S)- und (R,R)-Chiraphos handelt es sich um chirale Moleküle, die C2-Symmetrie besitzen. Die meso-Formen (R,S) und (S,R) sind achiral. Der Drehwert einer 1,5-molaren Lösung von (S,S)-Chiraphos in Chloroform bei 22 °C beträgt −191°.[2]
Verwendung
Chiraphos wird als chiraler Phosphinligand in der übergangsmetallvermittelten enantioselektiven Katalyse eingesetzt. Hierbei können mit Chiraphos sehr hohe Enantiomerenüberschüsse erzielt werden.
Einzelnachweise
- ↑ a b c Datenblatt Chiraphos bei Acros, abgerufen am 20. Februar 2010.
- ↑ a b c Datenblatt (2S,3S)-(−)-Bis(diphenylphosphino)butane bei Sigma-Aldrich, abgerufen am 16. März 2011.
- ↑ M. D. Fryzuk, B. Bosnich: Asymmetric synthesis. Production of optically active amino acids by catalytic hydrogenation, in: J. Am. Chem. Soc., 1977, 99, S. 6262–6267; doi:10.1021/ja00461a014.
Wikimedia Foundation.