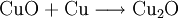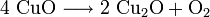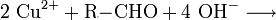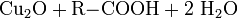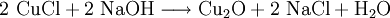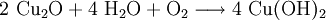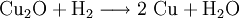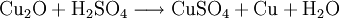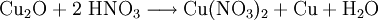- Cupro-oxyd
-
Kristallstruktur -oxid.png)
__ Cu+ __ O2- Allgemeines Name Kupfer(I)-oxid Andere Namen - Dikupferoxid
- Kupferoxydul
- Cuprum oxydulatum
- Cupro-oxyd
Verhältnisformel Cu2O CAS-Nummer 1317-39-1 Kurzbeschreibung gelbes bis rotbraunes, kristallines Pulver [1] Eigenschaften Molare Masse 143,09 g·mol−1 Aggregatzustand fest
Dichte 5,8–6,2 g·cm−3 [1]
Schmelzpunkt 1235 °C [1]
Siedepunkt thermische Zersetzung um 1800 °C [1]
Löslichkeit - unlöslich in Wasser [1]
- löslich in verdünnten Säuren
- löslich in Ammoniumhydroxid
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-50/53 S: (2)-22-60-61 MAK 0,1 mg·m−3 (gemessen als einatembarer Aerosolanteil) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(I)-oxid ist eine chemische Verbindung, die Kupfer und Sauerstoff enthält. In diesem Oxid mit der Summenformel Cu2O ist Kupfer einwertig. Kupfer(I)-oxid ist ein gelber bis rotbrauner Feststoff und wird beim Erhitzen schwarz, nimmt jedoch nach dem Abkühlen wieder seine ursprüngliche Farbe an.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Kupfer(I)-oxid als das Mineral Cuprit vor. Cuprit entsteht bei der Verwitterung von Kupfersulfiden und findet sich daher üblicherweise in oxidierten Teilen von Kupfervorkommen.
Gewinnung und Darstellung
Kupfer(I)-oxid kann durch die Reduktion von Kupfer(II)-oxid mit metallischem Kupfer bei erhöhter Temperatur oder durch die thermische Zersetzung von Kupfer(II)-oxid bei Temperaturen über 800 °C hergestellt werden. Kupfer(I)-oxid bildet sich zusammen mit Kupfer(II)-oxid beim Erhitzen von metallischem Kupfer auf Rotglut an Luft.
Kupfer(I)-oxid kann auch durch die Reduktion von Kupfer(II)-salzen in alkalischer Lösung oder durch die Reduktion von Kupfer(II)-hydroxid hergestellt werden. Geeignete Reduktionsmittel sind beispielsweise Hydrazin und Aldehyde. Die Reduktion von Kupfer(II)-salzen wird in der organischen Chemie zum Nachweis von reduzierenden Zuckern mit der Fehling-Probe angewandt.
Kupfer(I)-oxid kann durch die Reaktion von Kupfer(I)-chlorid mit Alkalihydroxiden hergestellt werden.
Eigenschaften
Kupfer(I)-oxid ist praktisch unlöslich in Wasser. Dagegen ist es in verdünnten Säuren löslich. Kupfer(I)-oxid ist unter Komplexbildung in Ammoniak oder Ammoniumhydroxid löslich. Der gebildete [Cu(NH3)2]+-Komplex ist, im Gegensatz zum [Cu(H2O)4]+-Komplex stabil. Letzterer disproportioniert in Cu und [Cu(H2O)6]2+.
Feuchtes Kupfer(I)-oxid wird an der Luft leicht zu blauem Kupfer(II)-hydroxid oxidiert. Trockenes Kupfer(I)-oxid reagiert dagegen nicht.
Kupfer(I)-oxid wird bei erhöhter Temperatur durch Wasserstoff zu metallischem Kupfer reduziert.
Kupfer(I)-oxid reagiert mit verdünnter Schwefelsäure zu Kupfer(II)-sulfat und metallischem Kupfer (Disproportionierung).
Kupfer(I)-oxid reagiert mit verdünnter Salpetersäure zu Kupfer(II)-nitrat und metallischem Kupfer (Disproportionierung).
Verwendung
Kupfer(I)-oxid wird für fäulnishemmende Anstriche verwendet, beispielsweise für Schiffsanstriche. Das in Lösung gehende Kupfer ist giftig für Algen und hemmt deren Ansatz auf den Schiffswänden. Daneben wird Kupfer(I)-oxid als Ausgangsstoff für die Herstellung von verschiedenen Kupferverbindungen genutzt. Weitere Anwendung findet es als Pigment zum Rotfärben von Glas und Emaille, als Fungizid und als Katalysator.
Kupfer(I)-oxid ist auch ein Halbleiter mit einer direkten Bandlücke von ca. 2 eV und wurde schon in den 1920er Jahren für den Bau von Gleichrichterdioden verwendet. Diese waren als Kupferoxydulgleichrichter bekannt. Selen und später Germanium und Silicium haben Cu2O später als Halbleitermaterial verdrängt, jedoch werden bis heute Grundlagenuntersuchungen an Cu2O durchgeführt, weil in diesem Material sehr leicht Exzitonen angeregt werden können.
Quellen
- ↑ a b c d e f Eintrag zu Kupfer(I)-oxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8. Dez. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1317-39-1 im European chemical Substances Information System ESIS
Weblinks
- http://www.mindat.org/min-1172.html (Englisch) Mineralogische Daten zu Cuprit
Wikimedia Foundation.