- Cystin
-
Strukturformel 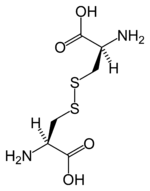
Allgemeines Name Cystin Andere Namen - (R,R)-Cystin
- L-(–)-Cystin
- IUPAC: (2R,2'R)-3,3'-Dithiobis(2-aminopropansäure)
Summenformel C6H12N2O4S2 CAS-Nummer 56-89-3 PubChem 595 ATC-Code V06DD
DrugBank NUTR00023 Kurzbeschreibung weißes Pulver mit schwachem Eigengeruch[1]
Arzneistoffangaben Wirkstoffklasse Aminosäure
Verschreibungspflichtig: Nein Eigenschaften Molare Masse 240,30 g·mol–1 Aggregatzustand fest
Schmelzpunkt pKs-Wert 1 [2]
Löslichkeit sehr schlecht in Wasser (190 mg·l−1 bei 20 °C)[2]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. L-Cystin [Synonym: (R,R)-Cystin] ist ein Disulfid, das durch Oxidation von zwei Molekülen der Aminosäure L-Cystein [Synonym: (R)-Cystein] entsteht. Die natürliche proteinogene α-Aminosäure L-Cystin wurde 1810 durch William Hyde Wollaston entdeckt und findet sich in hoher Konzentration peptidisch gebunden in den Zellen des Immunsystems, der Haut und den Haaren. So enthält Keratin (aus Haaren, Borsten oder Federn) etwa 11 % L-Cystin[3]. Es gibt auch Nierensteine, die aus L-Cystin bestehen.
Inhaltsverzeichnis
Herstellung und Gewinnung
Die Mehrheit des heute in der Lebensmiltelindustrie eingesetzten L-Cystins wird fermentativ gewonnen. Hierbei kommen genetisch modifizierte Bakterien vom Typ Escherichia coli zum Einsatz. Das von den Mikroorganismen gebildete L-Cystin kann anschließend aufgereinigt und kristallisiert werden. Da lediglich die Bakterienstämme, nicht aber deren Nährsubstrat gentechnisch modifiziert wurden und keine modifizierte DNA mehr im Produkt verbleibt, wird das gewonnene L-Cystin nicht als gentechnisch verändert eingestuft.
Ein zweiter Herstellungsprozess ist die saure Hydrolyse keratinhaltiger Proteine, wie Geflügelfedern, Haare und Hufe. Hierbei erhält man nach der Neutralisation ein Proteinhydrolysat, das aus den etwa 20 proteinogenen α-Aminosäuren besteht. Daraus lässt sich eine L-Cystin- und L-Tyrosin-reiche Fraktion leicht durch Abtrennung der gut wasserlöslichen Aminosäuren gewinnen, da L-Cystin- und L-Tyrosin sich nur wenig in Wasser lösen. Bis heute wird L-Cystin nach dieser einfachen Trennmethode kommerziell gewonnen[4].
Isomerie
Das Enantiomere des natürlichen L-Cystins ist D-Cystin [Synonym: (S,S)-Cystin]. Es besitzt ebenso wie das dritte Stereoisomer, das meso-Cystin, keine praktische Bedeutung.
Verwendung
Die elektrochemische Reduktion von L-Cystin (ein Disulfid) liefert L-Cystein (ein Thiol). Aus L-Cystin werden zahlreiche Arzneistoffe im industriellen Maßstab hergestellt, z. B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein.
Handelsnamen
Pantogar (A), Pantovigar (D), Priorin (A)
Einzelnachweise
- ↑ a b Datenblatt Cystin bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c d Cystin bei ChemIDplus.
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2.
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187-194.
Kategorien:- ATC-V06
- Aminosäure
- Organisches Disulfid
- Dicarbonsäure
- Arzneistoff
Wikimedia Foundation.
