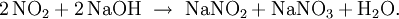- Distickstofftetraoxid
-
Strukturformel 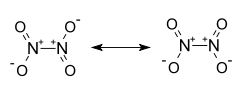
Allgemeines Name Distickstofftetroxid Andere Namen - Stickstofftetraoxid
- Stickstofftetroxid
- NTO
Summenformel N2O4 CAS-Nummer 10544-72-6 Kurzbeschreibung Durchsichtige Flüssigkeit, meistens durch gelöstes Stickstoffdioxid NO2 gelbbraun gefärbt Eigenschaften Molare Masse 92,01 g·mol−1 Aggregatzustand flüssig
Dichte 1,45 g·cm–3[1]
Schmelzpunkt −11,25 °C[1]
Siedepunkt 21,10 °C[1]
Dampfdruck Löslichkeit löslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Brand-
förderndSehr giftig (O) (T+) R- und S-Sätze R: 8-26-34 S: (1/2)-9-26-28-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Distickstofftetroxid N2O4 ist eine farblose Flüssigkeit. Es ist das Dimer des Stickstoffdioxids, NO2.
Distickstofftetroxid wird unter seinem Trivialnamen Stickstofftetroxid, beziehungsweise meist unter der Abkürzung NTO, in der Raumfahrt und Raketentechnik als ohne Kühlung lagerfähiges und hypergol mit Hydrazin und seinen Derivaten reagierendes Oxidationsmittel (Oxidator) verwendet.
Inhaltsverzeichnis
Eigenschaften
Distickstofftetroxid ist eine im reinen Zustand farblose, ätzende und stark oxidierend wirkende Flüssigkeit. Die kritische Temperatur für N2O4 beträgt 157,85 °C und der kritische Druck liegt bei 10 MPa. Oberhalb von 21,2 °C zerfällt ein Molekül N2O4 in zwei Moleküle NO2. Das rotbraune, paramagnetische NO2 steht mit dem farblosen, diamagnetischen Distickstofftetroxid N2O4 im Gleichgewicht, wobei sich dieses Gleichgewicht mit zunehmender Temperatur nach links verschiebt:
N2O4 und NO2 verhalten sich wie ein gemischtes Anhydrid der Salpetersäure und der Salpetrigen Säure. Mit Alkalihydroxidlösungen bilden sie Nitrate und Nitrite, z. B:
Herstellung
Distickstofftetroxid ist das Dimer des Stickstoffdioxids, das als Zwischenprodukt bei der großtechnischen Salpetersäuresynthese durch Luftoxidation von Stickstoffmonoxid NO entsteht. Durch Abkühlen unter 21,2 °C dimerisiert Stickstoffdioxid zu Distickstofftetroxid und kann so als Nebenprodukt in einer Salpetersäurefabrik produziert werden. Im Labor kann es analog gewonnen werden oder alternativ durch Reduktion von konzentrierter Salpetersäure mit Kupfer oder durch Erhitzen von Schwermetallnitraten wie Bleinitrat im Sauerstoffstrom.
Verwendung
Distickstofftetroxid wird unter dem Trivialnamen Stickstofftetroxid seit den 1950er Jahren in vielen Raketen als ohne Kühlung lagerfähiges Oxidationsmittel (Oxidator) verwendet. Zusammen mit Hydrazinderivaten als Reduktionsmittel bildet es die einzigen bei Träger- und Interkontinentalraketen verwendeten hypergolischen Treibstoffmischungen. So wurde es z. B. zusammen mit Hydrazin und UDMH als Treibstoff der Mondlandefähren im amerikanischen Apollo-Programm verwendet.
Zuerst wurde Distickstofftetroxid als lagerfähiger Oxidator bei den Interkontinentalraketen der zweiten Generation wie der Titan II verwendet, die dadurch immer vollgetankt und einsatzbereit auf ihren sofortigen Start warten konnten. Danach kam Distickstofftetroxid bei den aus diesen Interkontinentalraketen abgeleiteten Trägerraketen und zahlreichen neu entwickelten Trägerraketen bis heute zum Einsatz. Außerdem ist Distickstofftetroxid neben MON der Standardoxidator von Satelliten und Raumsonden.
Siehe auch
Quellen
- ↑ a b c d e Eintrag zu Distickstofftetroxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 7.2.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 10544-72-6 im European chemical Substances Information System ESIS
Wikimedia Foundation.