- Doppeltkohlensaures Natron
- Dieser Artikel beschäftigt sich mit der Chemikalie Natriumhydrogencarbonat (kurz Natron); zu weiteren Bedeutungen des Begriffes Natron siehe Natron.
- (doppeltkohlensaures) Natron
- Natriumbicarbonat
- Bikarbonat
- Backsoda
- Bullrich-Salz
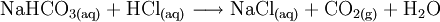
- Natriumhydrogencarbonat und Salzsäure reagieren zu Natriumchlorid, Kohlenstoffdioxid und Wasser.
- Im Magen muss aufgrund der dort aktiven Enzyme ein saures Milieu herrschen, dies geschieht durch Produktion von Chlorwasserstoff (HCl), woraus sich zusammen mit Wasser die Magensäure (ca. 0,5 prozentige Salzsäure) bildet, deren pH-Wert (nüchtern) bis auf 1–1,5 sinken kann. Die Epithelzellen der Magenwand, die bei einem solch niedrigen pH-Wert sofort zugrunde gehen würden, schützen sich selbst durch Abgabe von mit HCO3− versetztem Schleim[3]. Dringen H+-Ionen der Salzsäure in die Schleimschicht ein, so werden sie zu CO2 und Wasser neutralisiert. Das CO2 entweicht z. T. durch die Speiseröhre.
- Im Dünndarm wird wiederum eine alkalische Umgebung benötigt, da hier andere Enzyme die Spaltung der Nährstoffe übernehmen. Die Änderung des pH-Wertes erfolgt im Zwölffingerdarm durch Einspeisung des Sekretes der Bauchspeicheldrüse, welches unter anderem ebenfalls - wie der im Magen abgegebene Schleim - HCO3− enthält.
- Hydrogencarbonat HCO3− ist der wichtigste Blutpuffer zur Regulierung des Säure-Basen-Haushalts des Menschen.
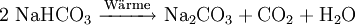
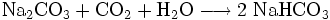
- In der Lebensmitteltechnik
- Bestandteil von Backpulvern
- Bestandteil von Brausepulvern
- In der Medizin
- früher als Mittel gegen Sodbrennen wegen der Neutralisationswirkung unter Bildung von ungiftigen Reaktionsprodukten (CO2 und Wasser); gilt heute als obsolet (siehe Antazidum, Protonenpumpenhemmer)
- Bei Diabetikern zur Neutralisierung saurer Stoffwechselprodukte
- Als Antidot bei Vergiftungen durch Barbiturate, Salicylate und Trizyklischen Antidepressiva[4]
- als Infusion zur Behandlung der metabolischen Azidose
- als Zusatz bei der Dialyse
- als Bestandteil von Brausetabletten (z. B. Aspirin® oder Alka-Seltzer®)
- In der Umwelttechnik
- als Absorptionsmittel für saure Abgasbestandteile (SOx, Cl) in Rauchgasreinigungsanlagen (Bicar-Verfahren)
- Historisch zur Dehydratisierung von Leichen (Mumifizierung).
- In der Landwirtschaft
- Bestandteil von Feuerlöschpulvern
- zum Strecken von synthetischen Drogen wie Amphetamin sowie zur Herstellung von Crack aus Kokain
- Im Haushalt
- zum Zähneputzen (Natron bzw. baking soda ist wegen seines abrasiven Effekts in vielen Zahnpastas enthalten, vor allem in Ländern wie den USA)
- zum Enthärten von Wasser (beispielsweise um Tee oder Kaffee zu kochen)
- als Putzmittel, z. B. zum Entfernen verkrusteter Speisereste: Indem man die Kruste auf dem Topfboden mit 1 Essl. Natron überpudert, das Ganze über Nacht stehen lässt und am folgenden Morgen mit einer Tasse Wasser aufkocht, kann man selbst sehr hartnäckige und scheuermilchpflichtige Verkrustungen lösen. Sie lösen sich in großen Flocken vom Topfboden. Dieses Verfahren ist gut geeignet für Edelstahl- und Emailletöpfe, Thermoskannen, Teekannen, Blumenvasen, Urinstein im WC usw.
- Eine Prise Natron im Kochwasser lässt Erbsen, Linsen und Bohnen schneller weich werden und nimmt verschiedenen Kohlsorten die blähende Wirkung.
- Als Beigabe zum fertigen Käsefondue macht es dieses leichter bekömmlich und luftig.
- Es neutralisiert Gerüche z. B.: Mundgeruch, Abflussrohre, muffige Schuhe, Kühlschrank, Katzentoilette, Kleintierkäfige …
- als Deo-Ersatz und bei Schweißfüßen als Fußbad anwendbar
- Trägt man einen Brei aus Natron und Wasser auf einen Insektenstich auf, vermindern sich Juckreiz und Schwellung schnell.
- Bei starkem Sonnenbrand tränkt man ein T-Shirt in Natron-Wasser und zieht es nass über. Hervorragende schnelle und schmerzlindernde Wirkung.
- Bei Sodbrennen hilft Natron sofort und dauerhaft. Die Wirkung zeigt sich dadurch, dass man leicht aufstoßen muss. (Gasbildung durch Neutralisation der (Magen-)Säure).
- Bei der Einnahme von Natriumhydrogencarbonat geht es einem nach einem Kater besser.
- Überschüssige Säure in Lebensmitteln wird durch Natron neutralisiert oder abgeschwächt. Dies ist etwa bei der Zubereitung von Konfitüren aus sehr sauren Früchten (z.B. Sanddorn oder Rhabarber) von Bedeutung, da diese so einen milderen Geschmack erhalten und daher auch weniger Zucker verwendet werden muss. Auch zu einer Speise versehentlich übermäßig zugesetzter Essig oder Zitronensaft kann durch Natron neutralisiert werden.
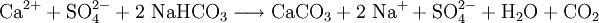
- In der Aquaristik.
- Erhöhung der Pufferkapazität zur Verhinderung eines Säuresturzes.
- ↑ a b c d Eintrag zu Natriumhydrogencarbonat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12. Februar 2008 (JavaScript erforderlich)
- ↑ a b Sicherheitsdatenblatt (Merck)
- ↑ Bikarbonatbatterie, S.E.Miederer, Fortschr Med.1994,Jun 10; 112(16):235–8, PubMed
- ↑ Antidot-Monographie für Natriumhydrogencarbonat(PDF)
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 |
|||||||
| Allgemeines | |||||||
| Name | Natriumhydrogencarbonat | ||||||
| Andere Namen |
|
||||||
| Summenformel | NaHCO3 | ||||||
| CAS-Nummer | 144-55-8 | ||||||
| Kurzbeschreibung | weißes, geruchloses Pulver [1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 84,01 g·mol−1 | ||||||
| Aggregatzustand |
fest |
||||||
| Dichte |
2,22 g·cm−3 (20 °C) [1] |
||||||
| Schmelzpunkt |
Zersetzung ab 50 °C [1] |
||||||
| Löslichkeit |
96 g·l−1 (bei 20 °C)[2] |
||||||
| Sicherheitshinweise | |||||||
|
|||||||
| LD50 |
4220 mg·kg−1 (oral, Ratte)[2] |
||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Natriumhydrogencarbonat, Summenformel NaHCO3, kurz Natron, wird oft auch mit dem chemisch falschen, teilweise sehr veralteten Trivialnamen doppeltkohlensaures Natron, Natriumbicarbonat oder Natriumbikarbonat bezeichnet – nicht zu verwechseln mit Natronlauge. Im Handel wird Natron auch unter Bezeichnungen wie „Speisesoda“, „Backsoda“, Speisenatron (z. B. in Rezepten) und unter den Traditionsmarken „KaiserNatron®“ oder „Bullrich-Salz®“ gehandelt. Es ist ein feines weißes Pulver und zersetzt sich oberhalb einer Temperatur von 65 °C unter Abspaltung von Wasser und Kohlenstoffdioxid zu Natriumcarbonat. Es ist ein Natriumsalz der Kohlensäure.
Inhaltsverzeichnis |
Etymologie
Das Wort Natron stammt in dieser Form aus dem Griechischen, ursprünglich aber aus dem Ägyptischen, wo der Konsonatenstamm „ntrj “ (= göttlich) für als heilig geltende Stoffe gebraucht wird, unter anderem für das im Wadi Natrun vorkommende natürliche Natron (eigentlich ein Gemisch aus Natron, Soda und Salz; ägyptisch sonst: hsmn) das zur rituellen Reinigung und zur Mumifizierung verwendet wurde. Der Elementname Natrium leitet sich von Natron ab.
Biologische Bedeutung
Mit Säuren reagiert es schäumend unter Bildung von Kohlenstoffdioxid und Wasser:
Die Möglichkeit, Säuren durch HCO3− zu neutralisieren, ist für den Körper überlebenswichtig.
Anwendungen in der Industrie
Wegen der thermischen Zersetzung von Natriumhydrogencarbonat, einsetzend oberhalb von 50 °C, wird es seit langer Zeit in der Lebensmitteltechnik als Backtriebmittel (im Backpulver zusammen mit Natriumhydrogenphosphat) und als Feuerlöschpulver genutzt.
Vorkommen
Natriumhydrogencarbonat kommt als natürliches Mineral Nahcolith in den USA vor. Die Verschwisterung mit Ölschiefer verhinderte aber eine industrielle Nutzung.
Herstellung
Umsetzung von gereinigter Natriumcarbonatlösung mit Kohlenstoffdioxid unter Kühlung:
Das durch Filtration gewonnene Natriumhydrogencarbonat muss vorsichtig getrocknet werden, damit es sich nicht wieder zersetzt.
Das als Zwischenprodukt im Solvay-Verfahren anfallende Natriumhydrogencarbonat wird wegen der Verunreinigungen normalerweise nicht verwendet.
Verwendung von Natron
Bei der Zugabe von Natriumhydrogencarbonat werden aus hartem Wasser Calcium- und Magnesiumionen als Carbonate ausgefällt:
Das weichere Wasser kann man dann nach Bodensatzbildung durch Abgießen, oder bereits vorher durch Filtrieren, von den Carbonaten trennen.
Einzelnachweise
Wikimedia Foundation.

