- Epimere
-
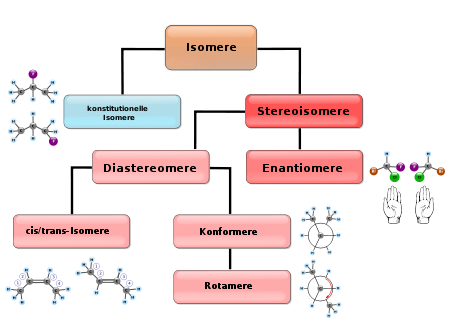
Isomere (Einzahl das Isomer, Genitiv: des Isomers, Genitiv Plural: der Isomere; von griechisch ἴσος ísos „gleich“ und μέρος méros „Teil“) sind chemische Verbindungen, die die gleiche Summenformel besitzen, sich aber in der Verknüpfung und der räumlichen Anordnung der einzelnen Atome unterscheiden. Dies führt teilweise auch zu abweichenden chemischen, physikalischen und biologischen Eigenschaften.
Inhaltsverzeichnis
Isomeriearten in der Organischen Chemie
Es gibt unterschiedliche Formen der Isomerie: Konstitutionsisomere und Stereoisomere.
Konstitutionsisomerie oder Strukturisomerie
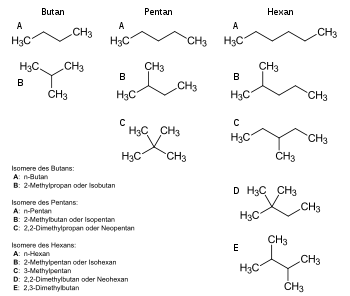
Konstitutionsisomere besitzen die gleiche Summenformel, aber eine andere Struktur (Konstitution). Die Isomere sind daher im Allgemeinen verschiedene Substanzen mit unterschiedlichen chemischen (u. a. Reaktivität) und physikalischen Eigenschaften (u. a. Schmelz- und Siedepunkt, Löslichkeit). Man kann mehrere Fälle unterscheiden:
- Funktionsisomere besitzen unterschiedliche funktionelle Gruppen, z. B. Ethanol (CH3-CH2-OH) und Dimethylether CH3-O-CH3.
- Skelettisomere haben verschieden verzweigte Kohlenstoffgrundgerüste, so Butanol und 2-Methyl-1-propanol.
- Bei Stellungsisomeren (auch Ortsisomere genannt) liegt die gleiche funktionelle Gruppe an verschiedenen Positionen, ein Beispiel ist 1,2-Propandiol und 1,3-Propandiol. Von Tautomerie spricht man, wenn die beiden Isomere in einer reversiblen chemischen Reaktion ineinander übergehen können, indem Teile des Moleküls (meist Wasserstoffatome) ihren Platz wechseln und sich gleichzeitig Bindungen verschieben.
- Bindungsisomere (auch Valenzisomere) unterscheiden sich in der Anzahl und/oder Position von σ- und π-Bindungen (wie etwa für C3H4, Propadien und Propin).
Stereoisomerie
 Die beiden Enantiomere der Milchsäure in einer Fischer-Projektion, (R)- bzw. (S)-Konfiguration am einzigen chiralen Kohlenstoffatom
Die beiden Enantiomere der Milchsäure in einer Fischer-Projektion, (R)- bzw. (S)-Konfiguration am einzigen chiralen KohlenstoffatomStereoisomere haben grundsätzlich die gleiche Struktur (Konstitution) – und damit auch die gleiche Struktur- und Summenformel – unterscheiden sich aber durch die räumliche Anordnung (Konfiguration) der Atome.
- Ein wichtiger Spezialfall sind Enantiomere, Stereoisomere, die sich wie Bild und Spiegelbild zueinander verhalten aber keine Symmetrieebene innerhalb des Moleküls aufweisen. Enantiomere unterscheiden sich deshalb in allen Stereozentren (Atome, die aufgrund von vier unterschiedlichen Substituenten unter diesen zwei verschiedene Reihenfolgen erlauben). Wichtige Beispiele sind Zucker, Aminosäuren und viele chirale Arzneistoffe.
- Alle Stereoisomere, die keine Enantiomere sind, bezeichnet man als Diastereomere. Ein Spezialfall ist die cis-trans-Isomerie an Doppelbindungen. Diastereoisomere unterteilen sich wie folgt:
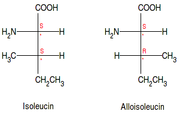
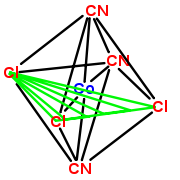
- Als Epimere bezeichnet man Paare von Diastereoisomeren eines Moleküls mit mehreren Stereozentren, die sich in einem dieser Zentren unterscheiden (z. B. Isoleucin und Alloisoleucin – siehe Grafik rechts – oder auch Glucose und Galactose), in den anderen jedoch gleich sind. Epimere sind somit immer auch Diastereomere, aber nicht umgekehrt.
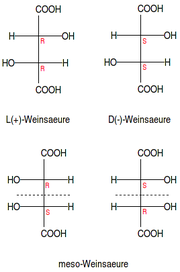
- Eine meso-Form besitzt zwar mehrere Chiralitätszentren, aber auch eine Symmetrieebene und lässt sich daher mit dem Spiegelbild zur Deckung bringen. Allgemein gültig ist die Formulierung, dass eine meso-Form äquivalente (mit den gleichen Resten substituierte) Chiralitätszentren mit entgegengesetzter Konfiguration (z. B. ein Stereozentrum mit (R)- und ein gleichsubstituiertes mit (S)-Konfiguration) besitzt. Zwei meso-Formen sind also entgegen dem ersten Anschein keine Enantiomere und optisch inaktiv (optischer Drehwert α = 0 Grad). Die Anzahl der Stereozentren in meso-Verbindungen ist geradzahlig (2, 4, 6, 8 usw.).
- In der Zuckerchemie benutzt man den Begriff Anomer als Spezialfall eines Epimers (Synonym: Diastereomer), dessen Unterschied am ersten Kohlenstoff liegt (relevant bei Bildung der α- oder β-Form eines Zuckers wie der Glucose).
Allen diesen Gruppen ist gemeinsam, dass ein Isomer nur durch Bindungsbruch in eine andere Form überführt werden kann. Das trifft auf die letzte Gruppe von Isomeren, die auch unter den Oberbegriff Stereoisomere fallen, nicht zu: Konformationsisomere sind Stereoisomere, die sich schon durch die Drehung von Einfachbindungen ineinander überführen lassen. Thermische Energie bei Raumtemperatur reicht dafür meist aus. Ein Beispiel ist das ekliptische und das gestaffelte Ethan (gut sichtbar in der Newman-Projektion). Die beiden Gruppen des Ethans können im Prinzip in jedem beliebigen Winkel zueinander stehen, wobei die Energiedifferenz geringer als die thermische Energie ist, so dass in einer Lösung die isomeren Formen kontinuierlich ineinander übergehen und sich normalerweise nicht isolieren lassen.
Berechnung der maximalen Anzahl an Stereoisomeren eines Moleküls: 2n bei n Chiralitätszentren. Wenn meso-Formen vorhanden sind, verringert sich die Anzahl der Isomere jeweils pro meso-Form um eins.
Bsp: Cyclohexan mit sechs Substituenten hat sechs Stereozentren, also maximal 26 = 64 Stereoisomere.
Weitere Begriffe
Im Zusammenhang mit Stereoisomeren tritt oft optische Aktivität auf, d. h. Enantiomere drehen die Ebene von linear polarisiertem Licht um den gleichen Betrag in entgegengesetzte Richtungen.
Der Begriff der Mesomerie gehört trotz der sprachlichen Ähnlichkeit nicht in diesen Themenbereich.
Formen der Isomerie
Die folgende Tabelle gibt eine kurze Übersicht über die wichtigsten Formen der Isomerie:
Kategorie Variante Gemeinsamkeiten Unterschiede Unterschiedliche chem./phys. Eigenschaften Überführen nur durch Lösen von Bindungen Konstitutionsisomere Summenformel Struktur ja ja Stereoisomere Konfigurationsisomere Diastereomere Summenformel
+
Strukturräumliche Anordnung ja ja Enantiomere räumliche Anordnung, aber wie Bild und Spiegelbild optisch aktiv, Unterschiede bei chiralen Reaktionspartnern (Enzyme) ja Konformationsisomere räumliche Stellung ja nein Isomeriearten in der Komplexchemie
Auch in der Komplexchemie gibt es eine Reihe sehr unterschiedlicher Formen der Isomerie, aber alle Formen lassen sich wieder in zwei große Gruppen einteilen, die Konstitutionsisomere und die Stereoisomere.
Konfigurationsisomerie (Stereoisomerie)
Analog zur Stereoisomerie bei organischen Molekülen, unterscheidet man Komplexe die zwar eine gleiche Zusammensetzung, aber einen anderen räumlichen Aufbau haben. Je nach Geometrie des Komplexes, kann es zu unterschiedlichen Ausprägungen der Stereoisomerie kommen.
- Völlig analog zu einem Stereozentrum am Kohlenstoff in der organischen Chemie, können tetraedrische Komplexe mit vier unterschiedlichen Liganden als Bild und Spiegelbild vorliegen.
- Bei planar-quadratischen und oktaedrischen Komplexen kann eine cis/trans-Isomerie vorliegen.
- Liegen drei gleiche Liganden in einem oktaedrischen Komplex vor, kann zwischen fac(ialen)- und mer(idionalen)-Isomeren unterschieden werden.
- Ionisationsisomere: Bei Komplexen, durch Auswechseln eines Liganden in der Koordinationssphäre mit einem gebundenen Ion, z.B. a) [Co(NH3)4(SO4)]Br (rot), b) [Co[NH3]4Br]SO4 (violett)
- Hydratisomere: Sind ein Spezialfall der Ionisationsisomere, bei dem Wassermoleküle als Liganden beteiligt sind, z.B. a) [Cr(OH2))6]Cl3 (grün), b) [Cr(OH2)5 Cl)]Cl2·H2O (violett)
Konstitutionsisomerien
- Bindungsisomerie (Salzisomerie)
Sie tritt immer dann auf, wenn ein Ligand über mehrere verschiedene seiner Atome mit dem Zentralatom verbunden werden kann.
Beispiele:
- Nitrokomplex oder Nitritokomplex
-
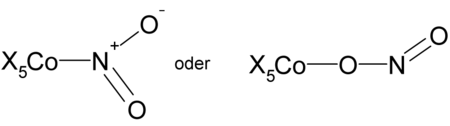 Nitrokomplex (links) oder Nitritokomplex (rechts) mit einen beliebigen Liganden X (z. B. NH3, H2O...) und Cobalt als Zentralatom (freie Elektronenpaare wurden weggelassen)
Nitrokomplex (links) oder Nitritokomplex (rechts) mit einen beliebigen Liganden X (z. B. NH3, H2O...) und Cobalt als Zentralatom (freie Elektronenpaare wurden weggelassen)
- Cyanat (-OCN) und Isocyanat (-NCO)
- Thiocyanat (-SCN) und Isothiocyanat (-NCS)
- Koordinationsisomerie
Liegen in einem Komplex sowohl Anion als auch Kation als Komplexe vor, können die Liganden von Zentralatom 1 mit dem Zentralatom 2 vertauscht werden.
Bedeutung in der Medizin
Pharmakologische Bedeutung
In der Medizin kann der Stereoisomerie von Arzneistoffen eine erhebliche Bedeutung zukommen. Zahlreiche Arzneistoffe enthalten mindestens ein Stereozentrum. Die unterschiedlichen Enantiomere (bei mehreren Stereozentren Isomere) können unterschiedliche pharmakodynamische und pharmakokinetische Eigenschaften besitzen; im Hinblick auf die Pharmakodynamik ist dies insbesondere davon abhängig, ob sich das Stereozentrum in einem für die Wirkstoff-Rezeptor-Interaktion relevanten Bereich des Arzneistoffmoleküls befindet. Ist dies der Fall, dann ist sehr oft - jedoch nicht immer - nur eines der Enantiomere für die erwünschten Wirkungen verantwortlich; dieses wird auch als Eutomer bezeichnet. Das andere Enantiomer (das Distomer) kann zur Hauptwirkung beitragen, unwirksam, im ungünstigen Fall aber auch schädlich oder toxisch sein. Im letzten Fall kann das Distomer als 50 %ige Verunreinigung des Wirkstoffs aufgefasst werden.[1] [2]
- Enantiomere
Ein in diesem Zusammenhang oft herangeführtes Beispiel ist der Arzneistoff Thalidomid, der als wirksamer Bestandteil des Schlafmittels Contergan in den 1960er Jahren zu zahlreichen Fehlbildungen bei Neugeborenen führte (Contergan-Skandal). Thalidomid wurde als Racemat eingesetzt; im Nachhinein zeigte sich, dass nur eines der Enantiomere für die teratogene Wirkung verantwortlich war. Ein Arzneimittel mit dem per se unschädlichen Enantiomer hätte jedoch die Schädigungen nicht verhindern können, da es im Magen-Darm-Trakt aufgrund einer Enolisierung am stereogenen Zentrum von Thalidomid zur Racemisierung kommt, d. h. auch aus dem unschädlichen Enantiomer hätte sich zu 50 % das schädigende Agens gebildet.
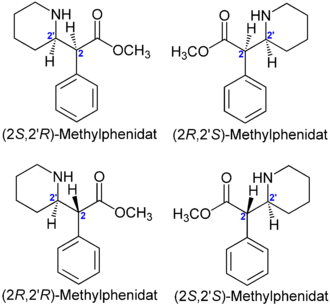
- Enantiomere und Diastereomere
Der Arzneistoff Methylphenidat besitzt zwei Stereozentren. Es gibt also vier Konfigurationsisomere: (2R,2' R)-Form, (2S,2' S)-Form, (2R,2' S)-Form und die (2S,2' R)-Form. Bei der Synthese entstehen die (2R,2' R)-Form und die (2S,2' S)-Form als Racemat in gleicher Menge. Weiterhin wird bei der Synthese das Racemat aus der (2R,2' S)-Form und der (2S,2' R)-Form gebildet. Methylphenidat ist in Deutschland als Gemisch dieser vier Stereoisomere im Handel (Equasym®, Medikinet®, Ritalin®). Die Verwendung von Stereoisomerengemischen als Arzneistoff ist umstritten.[1]
In den USA enthält das dort zugelassene Dexmethylphenidat (Focalin®) nur die wirksame reine (2R,2' R)-Form [(2R,2' R)-Methylphenidat] und weist deshalb weniger Nebenwirkungen als Methylphenidat auf, wirkt länger und ermöglichte eine niedrigere therapeutische Dosis.[3] [4] Eine Zulassung in Deutschland ist noch nicht absehbar.
Pharmazeutisch-chemische Bedeutung
Bei der klassischen chemischen Synthese wird in der Regel ein Racemat erzeugt, d. h. beide Enantiomere liegen zu gleichen Anteilen vor. Sofern ein enantiomerenreines Endprodukt gewünscht wird, muss daher eine asymmetrische Synthesestrategie verfolgt werden. Auch eine Trennung racemischer Wirkstoffe durch Racematspaltung wird oft angewandt. Mit Hilfe der Gentechnik oder durch Fermentation erzeugte pharmazeutische Wirkstoffe sind fast immer enantiomerenrein. Alternativ können Arzneistoffe auch aus Naturstoffen (dem chiralen Pool) synthetisiert werden, wobei in der Regel enantiomerenreine Produkte entstehen.
Quellen
- ↑ a b Ariëns EJ: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. Nr. 26, 1984, S. 663-668 (doi:10.1007/BF00541922) (PMID 6092093).
- ↑ Steinhilber D, Schubert-Zsilavecz M, Roth HJ: Medizinische Chemie. Targets und Arzneistoffe. Deutscher Apotheker-Verlag, Stuttgart 2005, ISBN 978-3769234831.
- ↑ Ding YS, Fowler JS, Volkow ND, Dewey SL, Wang GJ, Logan J, Gatley SJ, Pappas N: Chiral drugs: comparison of the pharmacokinetics of [11C]d-threo and L-threo-methylphenidate in the human and baboon brain. In: Psychopharmacology (Berl). Nr. 131, 1997, S. 71-78 (doi:10.1007/s002130050267) (PMID 9181638).
- ↑ Davids E, Zhang K, Tarazi FI, Baldessarini RJ: Stereoselective effects of methylphenidate on motor hyperactivity in juvenile rats induced by neonatal 6-hydroxydopamine lesioning. In: Psychopharmacology (Berl).. Nr. 160, 2002, S. 92-98 (doi:10.1007/s00213-001-0962-5) (PMID 11862378).
Literatur
- Ernest Ludwig Eliel, Arthur Lüttringhaus, Rudolf Cruse: Stereochemie der Kohlenstoffverbindungen. Wiley-VCH, Weinheim 1982, ISBN 3-527-25064-6.
- Ernest Ludwig Eliel; Samuel H. Wilen, Henning Hopf, Johann Mulzer: Organische Stereochemie. Wiley-VCH, Weinheim 1998, ISBN 3-527-29349-3.
- Bernard Testa: Grundlagen der Organischen Stereochemie. Verlag Chemie, Weinheim 1983, ISBN 3-527-25935-X.
Siehe auch
Weblinks
Wikimedia Foundation.