- Alpha-1-Antitrypsin-Mangel
-
Klassifikation nach ICD-10 E88.0 Störungen des Plasmaprotein-Stoffwechsels, anderenorts nicht klassifiziert ICD-10 online (WHO-Version 2011) Der α1-Antitrypsin-Mangel (Synonyme: Laurell-Eriksson-Syndrom, Proteaseinhibitormangel, AAT-Defizit) ist eine erbliche Stoffwechselerkrankung aufgrund eines Polymorphismus des Proteinase-Systems. Ein Mangel an Proteaseinhibitoren kann zu Leberzirrhose und Lungenemphysem führen.
Inhaltsverzeichnis
Funktion des α1-Antitrypsin
Das α1-Antitrypsin ist ein Akute-Phasen-Protein und einer der wichtigsten Proteinaseninhibitoren im Serum. Er hemmt u. a. die Proteinasen Trypsin und Neutrophilenelastase. Ein Mangel kann zu verstärkter Proteolyse führen.
Die normale Serumkonzentration beträgt 0,9-2,0 g/l.
 Modell des Alpha-1-Antitrypsin-Moleküls
Modell des Alpha-1-Antitrypsin-MolekülsGenetik
- Erbgang: autosomal-rezessiv (AR)
- Genlokus: Chromosom 14q32.1
- Häufigkeit: 1:1000 bis 1:2500
- Mechanismus: Proteolyse des Gewebes durch Proteasen (v.a. aus neutrophilen Granulozyten)
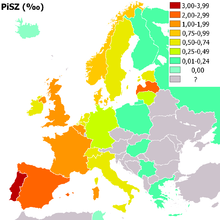
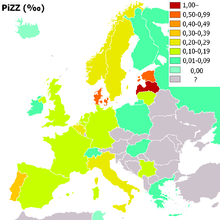
Mutationen an Position 342 (PiZZ) führen immer zu klinischen Erscheinungen, Mutationen an Position 264 (PiSS) bleiben jedoch meist stumm.
Pathogenese
Die Mutationen führen zu einer Konformationsänderung der Proteine. Dies hat eine gestörte Sekretion zur Folge. Es kommt zu Aggregation und Akkumulation im endoplasmatischen Retikulum (ER) der Leberzellen (Hepatozyten) und in weiterer Folge zu einem Mangel im Zellplasma (meist auf unter 40% des Normalwertes). Das hat eine verminderte Proteinaseinhibitor-Aktivität und somit verstärkte Proteolyse zur Folge.
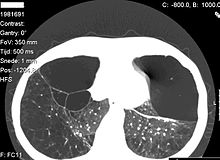
Die ungehemmte Leukozytenelastase zerstört das Lungengerüst. Es entwickelt sich ein progredientes Lungenemphysem. Die Akkumulation von α1-Antitrypsin im endoplasmatischen Retikulum der Hepatozyten führt zu Zellschäden und in weiterer Folge zu Fibrose und Leberzirrhose.
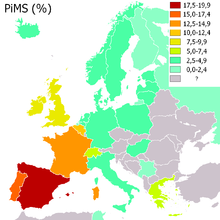
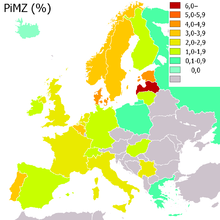
Lebenszeitrisiko nach Genotyp Genotyp
Typische
Serum-
konzentrationEmphysem-
risiko
Cirrhose-
risiko
PiMM
(normal)20–48 μMOL
1,50–3,50 g/l (r.i.d.)
1,50–3,00 g/lnormal normal PiMS
(Träger,
subklinisch)0,94–2,70 g/l normal normal PiSS
(homozygot,
mild)15–33 μMOL
1,00–2,00 (r.i.d.)
1,00–1,40 g/lnormal oder
leicht erhöhtnormal PiMZ
(Träger,
mild bis moderat)17–33 μMOL
0,90–2,10 g/l (r.i.d.)
0,90–1,50 g/lleicht erhöht normal oder
leicht erhöhtPiSZ
(moderat)8–16 μMOL
0,75–1,20 g/l (r.i.d.)
0,45–0,80 g/lerhöht
(20–50 %)erhöht PiZZ
(homozygot,
schwer)2,5–7 μMOL
0,20–0,45 (r.i.d.)
0,15–0,50 g/lsehr hoch
(80–100 %)erhöht
(20 %)PiZ0 0,0 μMOL
0,??–0,?? g/lsehr hoch
(80–100 %?)erhöht Pi00 0,00 g/l definitiv
(100 %)normal Symptome
Bei den meisten Patienten liegt eine chronisch-aktive Leberentzündung (Hepatitis) vor, die oft schon im Kindesalter auffällig wird. Im späteren Lebensalter entwickeln bis zu 40 % der Betroffenen eine Leberzirrhose und etwa 15 % ein hepatozelluläres Carcinom (HCC).
Die bedeutendste Manifestation bei Homozygoten ist die chronisch-obstruktive Lungenerkrankung. Diese tritt meist erst nach dem 30. Lebensjahr auf. Im Schnitt versterben die meisten Patienten um das 50. Lebensjahr an den Folgen eines Lungenemphysems. Todesursache ist durch die respiratorische Insuffizienz verursachte Hypoxämie (Multiorganversagen aufgrund des Sauerstoffmangels) oder aufgrund einer Hyperkapnie (ein arterieller Kohlendioxidpartialdruck > ca. 70 mmHg wirkt zunehmend atemsuppressiv) auch ist eine Rechtsherzinsuffizienz bei bestehendem Cor pulmonale möglich.
Gelegentlich kommt es zu Glomerulonephritis, nekrotisierender Vaskulitis, Wegener-Granulomatose, nekrotisierender Pannikulitis, Pankreatitis und Pankreasfibrose.
Diagnostik
Die diagnostischen Kriterien für den Nachweis eines α1-Antitrypsinmangels sind:
- α1-Antitrypsin < 0,9 g/l
- Nachweis der Genotypen PiZZ, PiMZ und PiSZ
- PAS-positive, proteaseresistente hepatozelluläre Einschlusskörperchen (=Antitrypsinablagerungen)
Therapie
Es gibt zur Zeit keine kausale Therapie des α1-Antitrypsin-Mangels. In erster Linie werden die Folgeerkrankungen behandelt, vor allem die Chronisch obstruktive Lungenerkrankung. Ein absoluter Rauchverzicht ist unbedingt nötig, da die im Rauch enthaltenen Oxidantien α1-Antitrypsin inaktivieren. Infekte müssen umgehend behandelt werden um die Konzentration an Akute-Phase-Proteinen gering zu halten. In diesem Zusammenhang sind auch Impfungen von Bedeutung (Grippe, Pneumokokken).
Substitutionstherapie
Bei schwerem Lungenemphysem empfiehlt sich der parenterale Ersatz (Substitutionstherapie) von α1-Antitrypsin (Prolastin® 60 mg/kg). Es sollte ein Spiegel über 0,8 g/l angestrebt werden. Die Substitution bringt keinen Vorteil bei Vorliegen eines Leberschadens, weil hier die Akkumulation im Vordergrund steht. Der Effekt der Substitutionstherapie wird eher als gering eingeschätzt.
Organtransplantation
Im fortgeschrittenen Stadium kann eine Lungen- oder Lebertransplantation nötig sein. Die Lebertransplantation ist kurativ, weil α1-Antitrypsin kaum in extrahepatischem Gewebe synthetisiert wird.
Assoziierte Erkrankungen
α1-Antitrypsin-Mangel ist mit einer Reihe von Erkrankungen assoziiert:
- Leberzirrhose
- COPD
- Pneumothorax
- Asthma
- Wegener-Granulomatose
- Pankreatitis
- Cholezystolithiasis (Gallensteine)
- Bronchiektasien
- Prolaps von Beckenorganen
- Primär sklerosierende Cholangitis
- Autoimmunhepatitis
- Emphysem, betrifft vorwiegend die Unterlappen und verursacht Bullae
- Carcinome (Krebs)
Literatur
- Alexander Biedermann, Thomas Köhnlein: Alpha-1-Antitrypsin-Mangel – eine versteckte Ursache der COPD: Überblick über Pathogenese, Diagnostik, Klinik und Therapie. Deutsches Ärzteblatt, 103. Jahrgang, Ausgabe 26 vom 30. Juni 2006, Seite A-1828 / B-1569 / C-1518
- Fregonese L, Stolk J: Hereditary alpha-1-antitrypsin deficiency and its clinical consequences. Orphanet J Rare Dis. 2008 Jun 19;3:16. Review. PMID 18565211
- Silverman EK, Sandhaus RA.Clinical practice: Alpha1-antitrypsin deficiency. New England Journal of Medicine (2009) vol 360 (26), S. 2749-2757.Review. PMID: 19553648
- Stoller J, Aboussouan L (2005). Alpha1-antitrypsin deficiency Lancet 365 (9478): 2225–36. PMID 15978931

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Krankheitsbild in der Pneumologie
- Krankheitsbild in der Gastroenterologie
- Hepatologie
- Krankheitsbild in der Kinderheilkunde
- Erbkrankheit
- Stoffwechselkrankheit
Wikimedia Foundation.