- Methacrylsäure
-
Strukturformel 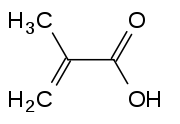
Allgemeines Name Methacrylsäure Andere Namen - Methylacrylsäure
- 2-Methylpropensäure
- alpha-Methylacrylsäure
- Isobutensäure
- MAA (Methacrylic acid)
Summenformel C4H6O2 CAS-Nummer 79-41-4 PubChem 4093 Kurzbeschreibung farblose Flüssigkeit mit stechendem Geruch[1]
Eigenschaften Molare Masse 86,09 g·mol−1[1] Aggregatzustand flüssig
Dichte 1,02 g·cm−3[1]
Schmelzpunkt Siedepunkt 161 °C[1]
Dampfdruck Löslichkeit mischbar mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Gefahr
H- und P-Sätze H: 312-302-314 EUH: keine EUH-Sätze P: 260-280-302+352-301+330+331-305+351+338-309-310 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 21/22-35 S: (1/2)-26-36/37/39-45 MAK 5 ml·m−3 oder 18 mg·m−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methacrylsäure ist eine ungesättigte Carbonsäure, eine sogenannte Alkensäure, und wird als Ausgangsstoff zur Herstellung von Kunststoffen verwendet.
Inhaltsverzeichnis
Geschichte und Vorkommen
Methacrylsäure wurde von Edward Frankland und Baldwin Francis Duppa zuerst in Form ihres Ethylesters durch Reaktion von Phosphorpentachlorid mit einem Ester der Isobuttersäure erhalten.[3] Die polymere Form der Methacrylsäure wurde im Jahre 1880 zuerst beschrieben.[4] Sie kommt als Ester natürlich in Kamillenöl vor.
Gewinnung und Darstellung
Mehr als 3 Millionen Tonnen Methacrylsäure werden jährlich produziert, wobei ein erheblicher Teil von Synthesen anderer chemischer Verbindungen ebenfalls über die Zwischenstufe Methacrylsäure gehen. Industriell wird sie aus Isobutylen und tert-Butanol hergestellt, welche erst zu Methacrolein und dieses dann weiter zu Methylmethacrylat oxidiert werden.[5] Synthetisch kann sie ebenfalls durch Hydrolyse von Acetoncyanhydrin und anschließende Wasserabspaltung hergestellt werden.
Eigenschaften
Physikalische Eigenschaften
Methacrylsäure ist eine farblose Flüssigkeit mit unangenehmem Geruch. Die Dämpfe der Methacrylsäure sind schwerer als Luft. Feste Methacrylsäure bildet prismatische Kristalle.
Chemische Eigenschaften
Methacrylsäure löst sich in Wasser, Alkohol und Ether; die wässrige Lösung reagiert stark sauer. Sie polymerisiert sehr leicht beim Erwärmen, bei Zutritt von Licht oder in Gegenwart von Salzsäure bzw. Peroxiden unter Bildung hochpolymerer Produkte. Durch Zusatz von Stabilisatoren wie Hydrochinon kann Methacrylsäure dennoch längere Zeit in monomerer Form aufbewahrt werden. Die Salze und Ester werden als Methacrylate bezeichnet.
Verwendung
Bei der Herstellung von Kunststoffdispersionen durch die Emulsionspolymerisation wird häufig ein geringer Anteil Methacrylsäure u. a. zur Erhöhung der kollidalen Stabilität copolymerisiert. Im Gegensatz zur Acrylsäure wird die Methacrylsäure dabei gleichmäßiger in die Teilchen eingebaut. Wässrige (neutralisierte) Lösungen polymerer Methacrylsäure oder methacrylsäurehaltiger Copolymere finden Verwendung als Netzmittel oder Verdicker z.B. bei der Herstellung von Dispersionsfarben. Es dient jedoch auch zur Herstellung anderer Monomere (z. B. Hydroxyethylmethacrylat, kurz HEMA, CAS: 868-77-9).
Die Ester der Methacrylsäure (Veresterung mit Butyl- oder längerkettigen Alkoholen) werden zur Herstellung von Kunststoffen verwendet. Wichtige Polymethacrylate (Polymethylmethacrylate oder Polymethacrylsäureester) sind:
- Polymethacrylsäuremethylester, Polymethylmethacrylat, kurz PMMA, Plexiglas aus Methacrylsäuremethylester, dem Methylester der Methacrylsäure
- Polymethacrylsäureethylester, kurz PMAA
- Polymethacrylsäurepropylester, kurz PMAP
- Polymethacrylsäureisopropylester
- Eudragit: Die verschiedenen Varianten von Eudragit sind anionische Copolymere von Methacrylsäure und Methylmethacrylat. Sie sind in Magensaft und in reinem Wasser unlöslich. In neutralen bis alkalischen Medien lösen sie sich durch Salzbildung mit Alkali auf und liefern magensaftresistente und darmsaftlösliche Überzüge. Auf diese Weise kann man Medikamente gut geschützt durch den Magen transportieren.[6]
Sicherheitshinweise
Methacrylsäure kann in einer Runaway Reaction spontan sehr heftig, je nach Bedingungen explosionsartig und unter Zersetzung polymerisieren. Käufliche Methacrylsäure ist daher immer mit einem Polymerisationsinhibitor versetzt. Bei der Lagerung ist darauf zu achten, dass die Säure nicht einfriert (Erstarrungstemperatur 15 °C). Beim Einfrieren verarmt die kristallisierte Methacrylsäure an Inhibitor und Sauerstoff, da diese zum Teil ausfallen, so dass auch nach dem Auftauen noch ein starkes Konzentrationsgefälle des Inhibitors innerhalb des Lagerbehälters auftreten kann. Eingefrorene Methacrylsäure muss daher vorsichtig (Temperaturen über 50 °C sind zu vermeiden), langsam und unter ständiger Durchmischung aufgetaut werden. Dies sollte nur durch sachkundige Personen durchgeführt werden (die Hersteller stellen dazu im Sicherheitsdatenblatt eine Beratungsmöglichkeit, häufig auch eine Notfallhotline zur Verfügung). Ist diese nicht zur Stelle, so kann die kristallisierte Acryl- oder Methacrylsäure unterhalb des Schmelzpunktes, jedoch unter 0 °C gelagert werden. In diesem Zustand ist Methacrylsäure unkritisch. Keinesfalls darf aus teilweise eingefrorenen Behältern flüssige Säure entnommen werden, da dadurch ein Großteil des Inhibitors mit entnommen wird und so beim Wiederaufschmelzen des eingefrorenen Teils der Methacrylsäure nicht mehr zur Verfügung steht.
Siehe auch
- Acrylsäure
- Methacrolein C4H6O, CAS: 78-85-3
- Methylmethacrylatklebstoff
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 79-41-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9.9.2007 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 79-41-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Edward Frankland Annalen, 1865, 136, p. 12
- ↑ F. Engelhorn et al. Ann., 1880, 200, p. 70.
- ↑ William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441. Article Online Posting Date: June 15, 2000
- ↑ EUDRAGIT® L 30 D-55 (Evonik)
Wikimedia Foundation.

