- Acrylsäure
-
Strukturformel 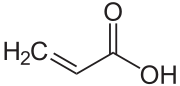
Allgemeines Name Acrylsäure Andere Namen - Prop-2-ensäure
- Propensäure
- Ethylencarbonsäure
- Vinylcarbonsäure
Summenformel C3H4O2 CAS-Nummer 79-10-7 PubChem 6581 Kurzbeschreibung farblose Flüssigkeit mit stechendem, essigsäureähnlichem Geruch [1]
Eigenschaften Molare Masse 72,06 g·mol−1 Aggregatzustand flüssig
Dichte 1,05 g·cm−3[1]
Schmelzpunkt Siedepunkt 141 °C[1]
Dampfdruck pKs-Wert 4,26[2]
Löslichkeit - vollständig mischbar mit Wasser, Ethanol und Diethylether[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 



Gefahr
H- und P-Sätze H: 226-332-312-302-314-400 EUH: keine EUH-Sätze P: 280-273-302+352-301+330+331-305+351+338-309-310 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 10-20/21/22-35-50 S: (1/2)-26-36/37/39-45-61 MAK 10 ml·m−3 bzw. 30 mg·m−3[1]
LD50 2590 mg·kg−1 (oral, Ratte)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Acrylsäure oder Propensäure gehört zu den ungesättigten Carbonsäuren. Sie ist eine farblose, mit Wasser mischbare bei Raumtemperatur flüssige chemische Verbindung mit stechendem, essigähnlichem Geruch. Acrylsäure wirkt stark korrodierend und ist entzündlich.
Inhaltsverzeichnis
Darstellung
Die großindustrielle Herstellung erfolgt durch eine zweistufige Oxidation von Propen mit Hilfe von Katalysatoren. In der ersten Stufe wird Propen mit Luft an Bismut-Molybdänoxid-Katalysatoren bei Temperaturen um 300 °C zu Propenal (Acrolein) umgesetzt. In der zweiten Stufe erfolgt die Oxidation von Propenal an Molybdän-Vanadiumoxid-Katalysatoren bei Temperaturen von 250 bis 300 °C zu Acrylsäure.
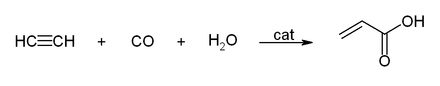
Die Darstellung kann auch über Hydrocarboxylierung nach Walter Reppe aus Acetylen, Kohlenmonoxid und Wasser erfolgen, die Methode hat aber in der heutigen Zeit keine großtechnische Anwendung.
Eigenschaften
Physikalische Eigenschaften
Acrylsäure ist eine farblose Flüssigkeit, die unter Normaldruck bei 141 °C siedet. Die Verdampfungsenthalpie beträgt 53,1 kJ·mol-1.[5] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 2,69607, B = 621,275 und C = −121,929 im Temperaturbereich von 293 K bis 343 K.[6] Die Substanz schmilzt bei 13 °C mit einer Schmelzenthalpie von 9,5 kJ·mol-1.[7] Die kritische Temperatur liegt bei 343 °C, der kritische Druck bei 52,43 bar.[8]
Chemische Eigenschaften
Acrylsäure neigt stark zur Polymerisation und wird mit kleinen Mengen Hydrochinonmonomethylether stabilisiert. Die Lagerung sollte unterhalb von 25 °C erfolgen. Dabei ist darauf zu achten, dass der Festpunkt nicht unterschritten wird. Bei der Kristallisation würde sich stabilisatorfreie Reinst-Acrylsäure als Feststoff abscheiden, die beim Auftauen, da unstabilisiert, explosionsartig polymerisieren kann. Die Polymerisationsenthalpie beträgt 75 kJ·mol-1 (18,5 kcal/mol).
Sicherheitstechnische Kenngrößen
Acrylsäure bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 48–55 °C.[1] Der Explosionsbereich liegt zwischen 3,9 Vol% als untere Explosionsgrenze (UEG) und 19,8 Vol% als obere Explosionsgrenze (OEG).[1] Die Grenzspaltweite wurde mit 0,86 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[1] Die Zündtemperatur beträgt 395 °C.[1] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Ihre Hauptverwendung ist die Polymerisation zu Superabsorbern (Anwendung z. B. in Windeln), Acrylatestern (die wiederum zur Herstellung von Polymeren verwendet werden) und als Comonomer bei der Herstellung von Polymerdispersionen.
Einzelnachweise
- ↑ a b c d e f g h i j k l m Eintrag zu CAS-Nr. 79-10-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. April 2010 (JavaScript erforderlich)
- ↑ Fieser und Fieser, Organische Chemie, 2. Auflage, Verlag Chemie 1982 ISBN 3-527-25075-1
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Eintrag zu CAS-Nr. 79-10-7 im European chemical Substances Information System ESIS
- ↑ Van-chin-syan, Yu.Ya.; Kochubei, V.V.; Sergeev, V.V.; Raevskii, Yu.A.; Gerasimchuk, S.I.; Kotovich, Kh.Z.: Thermodynamic properties of some acids and aldehydes of the acrylic series in Sov. J. Chem. Phys. (Engl. Transl.) 70 (1996) 1789-1794.
- ↑ Gubkov, A.N.; Fermor, N.A.; Smirnov, N.I.: Vapor Pressure of Mono-Poly Systems in Zh. Prikl. Khim. (Leningrad) 37 (1964) 2204-2210.
- ↑ Karabaev, M.K.; Abduzhaminov, T.P.; Kenisarin, M.M.; Saidov, A.A.: Thermodynamics of the crystal-liquid phase transition in acrylates and methacrylates in Izv. Akad. Nauk Uzb. SSR, Ser. Fiz.-Mat. Nauk, 1985, (5), 74-77.
- ↑ D'Souza, R.; Teja, A.S.: The prediction of the vapor pressures of carboxylic acids in Chem. Eng. Commun. 61 (1987) 13.
Weblinks
 Wiktionary: Acrylsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, ÜbersetzungenKategorien:
Wiktionary: Acrylsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, ÜbersetzungenKategorien:- Gesundheitsschädlicher Stoff
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Alkensäure
Wikimedia Foundation.