- Minocyclin
-
Strukturformel 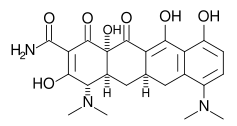
Allgemeines Freiname Minocyclin Andere Namen IUPAC: 4β,7-Bis(dimethylamino)-1,4,4a,5,5a,6,11,12a- octahydro- 3,10,12,12a-tetrahydroxy-1,11- dioxo-2-naphthacencarboxamid
Summenformel C23H27N3O7 CAS-Nummer - 10118-90-8
- 13614-98-7 (Minocyclin·Monohydrochlorid)
PubChem 5281021 ATC-Code DrugBank DB01017 Kurzbeschreibung gelbes, kristallines Pulver(Monohydrochlorid)[1]
Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 457,48 g·mol−1 Schmelzpunkt >175 °C (Zersetzung)(Monohydrochlorid)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2]
Minocyclin·Monohydrochlorid
Xi
ReizendR- und S-Sätze R: 36/37/38 S: 26-36 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Minocyclin ist ein Antibiotikum aus der Klasse der Tetracycline. Es besitzt ein breites Wirkspektrum und zeigt eine bakteriostatische Wirksamkeit auf grampositive, gramnegative und zellwandlose Keime. Minocyclin wird zur Behandlung von Infektionen der Atemwege und des Hals-Nasen-Ohren-Bereiches, bestimmter Formen der Lungenentzündung, Infektionen der Harnwege und der Geschlechtsorgane, des Magen-Darm-Traktes sowie bei Hauterkrankungen, schweren Formen der Akne, Bindehautentzündungen und Borreliosen eingesetzt.
Unabhängig von der antibakteriellen Wirkung von Minocyclin wurden seit dem Jahre 2000 auch Schutzeffekte für Nervenzellen nachgewiesen sowie für die Nieren bei Diabetes mellitus.[4][5][6]
Inhaltsverzeichnis
Herstellung
Die vielstufige Synthese des Wirkstoffes ist in der Literatur beschrieben.[7] Dabei wird ausgehend von fermentativ und partialsynthetisch gewonnenem 6-Demethyltetracyclin zunächst hydrogenolytisch eine benzylische Hydroxygruppe abgespalten. Anschließend wird eine Nitrogruppe durch Umsetzung mit Kaliumnitrat/Flusssäure in der ortho-Position zur phenolischen Hydroxygruppe eingeführt. Durch Reduktion dieser Nitrogruppe wie das entsprechende Anilin-Derivat erhalten. Mit Nitriersäure wird eine Nitrogruppe am aromatischen Ring in para-Stellung zur phenolischen Hydroxygruppe eingeführt. Die Diazotierung des Anilin-Derivates liefert das Diazoniumsalz. Durch katalytische Reduktion wird der Stickstoff des Diazonium-Salzes abgespalten und zugleich die zweite Nitrogruppe (in para-Stellung des Phenols) zur Aminogruppe reduziert. Diese Aminogruppe wird nun mit Formaldehyd zweifach methyliert, so dass Minocyclin resultiert. Der Arzneistoff enthält somit zwei Dimethylamino-Funktionen (siehe Box).
Entzündungshemmende und neuroprotektive Eigenschaften
Die aktuelle Forschung untersucht die mögliche neuroprotektive und entzündungshemmende Wirkung von Minocyclin gegen das Fortschreiten einer Gruppe von neurodegenerativen Erkrankungen wie Multiple Sklerose,[5] rheumatoide Arthritis, Chorea Huntington, Parkinson-Krankheit[8] und weiteren dieser Art,[6][9][10] sowie bei Schlaganfall.[11]
Eine Studie zur Anwendung von Minocyclin bei Amyotropher Lateralsklerose enttäuschte jedoch und zeigte indessen, dass der Wirktstoff bei dieser Krankheit scheinbar destruktive, krankheitsbeschleunigende Wirkung zeigen kann.[12]
Im Tiermodell orofazialer Schmerzen hat Minocyclin eine signifikant abschwächende Wirkung bei tiefer entzündungsbedingter Hyperalgesie des Musculus masseter gezeigt, nicht aber bei der Hyperalgesie der Unterhaut.[13] Es wird vermutet, dass die neuroprotektive Wirkung von Minocyclin unabhängig von den entzündungshemmenden Eigenschaften ist.[4]
Handelsnamen
Aknefug Mino (D), Aknoral (CH), Aknosan (D), Minakne (D), Skid (D), Skinocyclin (D), Udima (D, A), zahlreiche Generika (D, A, CH), Cyclin (Taiwan)
Einzelnachweise
- ↑ a b Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ a b c Datenblatt Minocycline hydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.3. Georg Thieme Verlag KG, Stuttgart 2009..
- ↑ a b Maier K, Merkler D, Gerber J, Taheri N, Kuhnert AV, Williams SK, Neusch C, Bähr M, Diem R: Multiple neuroprotective mechanisms of minocycline in autoimmune CNS inflammation. In: Neurobiol. Dis.. 25, Nr. 3, 2007, S. 514-25. doi:10.1016/j.nbd.2006.10.022. PMID 17239606..
- ↑ a b Zabad RK, Metz LM, Todoruk TR, Zhang Y, Mitchell JR, Yeung M, Patry DG, Bell RB, Yong VW: The clinical response to minocycline in multiple sclerosis is accompanied by beneficial immune changes: a pilot study. In: Mult. Scler.. 13, Nr. 4, 2007, S. 517-26. doi:10.1177/1352458506070319. PMID 17463074..
- ↑ a b Zemke D, Majid A: The potential of minocycline for neuroprotection in human neurologic disease. In: Clinical neuropharmacology. 27, Nr. 6, 2004, S. 293-8. PMID 15613934..
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ National Institute of Health Press release: Preliminary Study Shows Creatine and Minocycline May Warrant Further Study In Parkinson’s Disease. February 23, 2006.
- ↑ Tikka TM, Koistinaho JE: Minocycline provides neuroprotection against N-methyl-D-aspartate neurotoxicity by inhibiting microglia. In: J. Immunol.. 166, Nr. 12, Juni 2001, S. 7527–33. PMID 11390507.
- ↑ Xue M, Mikliaeva EI, Casha S, Zygun D, Demchuk A, Yong VW: Improving Outcomes of Neuroprotection by Minocycline. Guides from Cell Culture and Intracerebral Hemorrhage in Mice. In: Am J Pathol. Januar 2010. doi:10.2353/ajpath.2010.090361. PMID 20110416.
- ↑ Lampl Y, Boaz M, Gilad R, et al.: Minocycline treatment in acute stroke: an open-label, evaluator-blinded study. In: Neurology. 69, Nr. 14, 2007, S. 1404–10. doi:10.1212/01.wnl.0000277487.04281.db. PMID 17909152.
- ↑ "Forscher warnen: Vorsicht bei Minocyclin-Studie" auf ms-life.de - abgerufen am 20. Juli 2011
- ↑ Shimizu K, Guo W, Wang H, Zou S, LaGraize SC, Iwata K, Wei F, Dubner R, Ren K: Differential involvement of trigeminal transition zone and laminated subnucleus caudalis in orofacial deep and cutaneous hyperalgesia: the effects of interleukin-10 and glial inhibitors. In: Molecular Pain. 5, 2009, S. 75. doi:10.1186/1744-8069-5-75. PMID 20025765. Volltext bei PMC: 2806354.
Literatur
- Wang, J. et al. Minocycline up-regulates Bcl-2 and protects against cell death in mitochondria. J. Biol. Chem. 279, 19948–19954 (2004).
- Kelly, K.J. et al. Minocycline inhibits apoptosis and inflammation in a rat model of ischemic renal injury. Am. J. Physiol. Renal Physiol. 287, F760–F766 (2004).
- Chen, M. et al. Minocycline inhibits caspase-1 and caspase-3 expression and delays mortality in a transgenic mouse model of Huntington disease. Nat. Med. 6, 797–801 (2000).
- Hayakawa, K. et al. Delayed treatment with minocycline ameliorates neurologic impairment through activated microglia expressing a high-mobility group box1 inhibiting mechanism. Stroke 39(3), 951-8 (2008).
Weblinks

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-J01
- ATC-A01
- Reizender Stoff
- Polyphenol
- Carbonsäureamid
- Polyol
- Cyclohexanon
- Cyclohexenon
- Cyclohexadien
- Enol
- Aminobenzol
- Antibiotikum
- Arzneistoff
Wikimedia Foundation.
