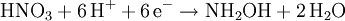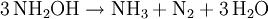- Oxyammoniak
-
Strukturformel 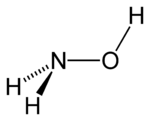
Allgemeines Name Hydroxylamin Andere Namen Oxyammoniak
Summenformel - H3NO (Hydroxylamin)
- H3NO·HCl (Hydroxylamin·Hydrochlorid)
CAS-Nummer - 7803-49-8 (Hydroxylamin)
- 5470-11-1 (Hydroxylamin·Hydrochlorid)
Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse Aggregatzustand fest
Dichte 1,216 g·cm–3 (14 °C)[1]
Schmelzpunkt Siedepunkt 142 °C[1]
Dampfdruck 1,9 mbar[1] (20 °C)
Löslichkeit - gut in Wasser, Ether, Schwefelkohlenstoff, Benzin und Chloroform
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 


Explosions-
gefährlichGesundheits-
schädlichUmwelt-
gefährlich(E) (Xn) (N) R- und S-Sätze R: 2-21/22-37/38-40-41-43-48/22-50 S: (2)-26-36/37/39-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hydroxylamin ist eine farblose, kristalline anorganische chemische Verbindung, die erstmals von Cornelis Adriaan Lobry van Troostenburg de Bruyn synthetisiert wurde.
Inhaltsverzeichnis
Synthese
Hydroxylamin wird durch Reduktion höherer Oxidationsstufen des Stickstoffs (NO, NO2-, NO3-) mit Wasserstoff, Schwefliger Säure oder elektrischem Strom hergestellt. Hydroxylamin wird technisch durch Einleiten eines Gemisches aus Stickstoffmonoxid und Wasserstoff in eine schwefelsaure Suspension eines Katalysators (Palladium oder Platin) auf Aktivkohle hergestellt, die Ausbeute beträgt bei dieser Methode 90 %.
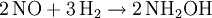
Eine andere technische Methode ist das Einleiten von Schwefeldioxid in eine Lösung von Ammoniumnitrit in Schwefelsäure bei 0 bis 5 °C. Hierbei einsteht zuerst Diammoniumhydroxylaminbis(sulfonat) N(SO3NH4)2OH, welches sich bei 100 °C durch Wasser langsam in Hydroxylamin und Hydrogensulfat spaltet. Auch bei dieser Methode beträgt die Ausbeute etwa 90 %.
Eine weitere technische Methode ist die Reduktion von Salpetersäure mit elektrischem Strom, wobei hierzu eine Lösung von Salpetersäure in 50%iger Schwefelsäure verwendet wird.
Reaktionsverhalten
Unter Luftausschluss ist Hydroxylamin einige Wochen haltbar. Als wässrige Lösung ist es unter Luftausschluss ziemlich stabil. Bei Anwesenheit von Luftsauerstoff zersetzt sich Hydroxylamin sowohl als Reinstoff wie auch als Lösung sehr schnell, oberhalb von 100 °C erfolgt die Zersetzung explosionsartig.
Wegen seiner Instabilität wird Hydroxylamin meist in seine Salze (beispielsweise Hydroxylaminhydrochlorid, Hydroxylammoniumsulfat) umgewandelt.
Die vergleichsweise hohen Schmelz- und Siedetemperaturen von Hydroxylamin lassen sich zum einen durch H-Brückenbildung, andererseits durch die teilweise Tautomerisierung zum Aminoxid, welches ionische Ladungen trägt, erklären. Außerdem wirkt Hydroxylamin leicht als Ampholyt.
Mutagene Wirkung
Hydroxylamin wandelt Cytosin durch Hydrolyse zu Uracil um. Uracil paart aber im Gegensatz zu Cytosin mit Adenin, weswegen sich das Basenpaar C-G nach zwei Replikationen zu T-A umwandelt. Da Uracil jedoch in der DNA nicht vorkommt, werden solche Fehler leicht erkannt und korrigiert.
Verwendung
Der größte Teil des industriell hergestellten Hydroxylamins wird mit Aldehyden oder Ketonen zu Oximen umgesetzt. 97 % der Weltjahresproduktion von Hydroxylamin wird zur Gewinnung von Cyclohexanonoxim aus Cyclohexanon verwendet, das über Caprolactam in Perlon umgewandelt wird. Siehe hierzu den Artikel zur Beckmann-Umlagerung.
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 7803-49-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 08.04.2007 (JavaScript erforderlich)
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 837, ISBN 978-0-911910-00-1.
- ↑ Eintrag zu CAS-Nr. 7803-49-8 im European chemical Substances Information System ESIS
Weblinks
Explosionsunglück bei der Herstellung von Hydroxylamin
Sicherheitsdatenblätter
Wikimedia Foundation.