- Paclitaxel
-
Strukturformel 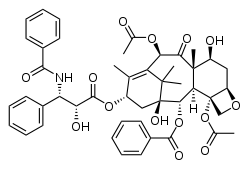
Allgemeines Freiname Paclitaxel Andere Namen - Abraxane
- Taxol
Summenformel C47H51NO14 CAS-Nummer 33069-62-4 PubChem 36314 ATC-Code L01CD01
DrugBank APRD00259 Kurzbeschreibung weißer Feststoff[1]
Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 853,92 g·mol−1 Schmelzpunkt Löslichkeit abhängig von der Modifikation und der Messmethode werden Löslichkeiten von ca. 0,1 mg·l−1 bis zu 30 mg·l−1 in Wasser angegeben. [3]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [4] 


Gefahr
H- und P-Sätze H: 318-361f-341-332-312-302-335-315-334-317 EUH: keine EUH-Sätze P: 280-305+351+338-260-261-342+311 [4] EU-Gefahrstoffkennzeichnung [2]
T
GiftigR- und S-Sätze R: 36/37-41-46-60 S: 22-26-36/37/39-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Paclitaxel ist eine in der Pazifischen Eibe (Taxus brevifolia) vorkommende Substanz aus der Gruppe der Taxane. Paclitaxel wird als Arzneistoff in der Medizin zur Behandlung verschiedener Krebsarten (z. B. Brustkrebs) eingesetzt.
Inhaltsverzeichnis
Eigenschaften
Paclitaxel ist bei Raumtemperatur ein farbloser Feststoff. In Wasser ist es kaum löslich. Es gibt mindestens drei kristalline Formen, eine davon ist ein Dihydrat. Es sind auch glasig erstarrte Modifikationen mit einem Glasübergang um 152 °C beschrieben. Die verschiedenen Angaben zur Löslichkeit können auf das Vorliegen unterschiedlicher Kristallstrukturen bzw. die Bildung eines schwerer löslichen Dihydrates in wässriger Lösung zurückgeführt werden.
Gewinnung
Paclitaxel kann aus der Rinde der Pazifischen Eibe (Taxus brevifolia) gewonnen werden. Da diese Eibenart nur sehr wenig verbreitet ist und der Taxolgehalt gering ist, kann sie nicht den Weltbedarf an Paclitaxel decken. Seit einigen Jahren wird daher Paclitaxel partialsynthetisch aus Baccatin III gewonnen, das in den Nadeln der Europäischen Eibe (Taxus baccata) vorkommt. Dies geschieht nach dem Ojima-Holton-Verfahren, das unter anderem von Iwao Ojima entwickelt wurde. Eine weitere Methode zur industriellen Herstellung ist die biotechnologische Gewinnung von Paclitaxel aus Eibenzellkulturen.[6]
Eine Totalsynthese von Paclitaxel wurde erstmals im Jahr 1994 von Kyriacos C. Nicolaou beschrieben, fand jedoch keine industrielle Verwendung. Eine weitere Synthesemöglichkeit mithilfe der Chan-Umlagerung wurde im selben Jahr von Robert A. Holton gefunden.
Es wurde nachgewiesen, dass Paclitaxel auch durch den endophytisch lebenden Pilz Taxomyces andreanae biosynthetisiert wird, der symbiotisch in oder auf Pflanzen lebt.
Entdeckung
Monroe E. Wall und M. C. Wani führten in den späten 1960er-Jahren gemeinsam eine umfassende Suche nach Anti-Krebs-Wirkstoffen durch. Dabei konnten sie im Jahre 1971 die Substanz Paclitaxel durch Extraktion der Rinde der Pazifischen Eibe (Taxus brevifolia) erstmals isolieren, charakterisieren und seine wucherungshemmende Wirkung auf Zellen, u. a. Krebszellen, feststellen.[7]
Pharmakologie
Anwendungsgebiete
Paclitaxel wird in der Therapie maligner Tumore (Chemotherapie) eingesetzt. Zu seinen Anwendungsgebieten gehören u. a. Ovarialkarzinome (in Kombination mit Cisplatin), Mammakarzinome (ggf. in Kombination mit Trastuzumab) und das nicht-kleinzellige Bronchialkarzinom (in Kombination mit Cisplatin oder Carboplatin) sowie das Prostatakarzinom (hier vor allem die synthetische Variante Docetaxel). Ferner wird es neben Sirolimus bei der Herzkatheterisierung (perkutane transluminale Koronarangioplastie, PTCA) zur Beschichtung von Stents („drug-eluting stents“) und Medikament-freisetzender Ballonkatheter (Drug-Eluting Ballons) verwendet, wodurch das Risiko eines erneuten Verschlusses der Koronararterie vermindert werden soll.
Wirkmechanismus
Paclitaxel wirkt, indem es die Teilung von Zellen (Mitose) stört. Es bindet an β-Tubulin und stört den Abbau von Mikrotubuli, die bei der Mitose Bestandteil der essenziellen Mitosespindel sind. Im Gegensatz zu Colchicin, Vinblastin und Nocodazol, die direkt den Aufbau der Mikrotubuli hemmen, inhibiert Paclitaxel deren Abbau.
Es wirkt somit auf alle sich teilenden Zellen, ist also nicht ohne Nebenwirkungen. Da Krebszellen sich schnell teilen, sind diese jedoch stärker betroffen.
Nebenwirkungen
Unter der Therapie mit Paclitaxel konnten folgende Nebenwirkungen beobachtet werden, die charakteristisch für die meisten Zytostatika sind: Knochenmarksuppression mit Blutbildveränderungen (Thrombozytopenie, Neutropenie, Anämie), Neuropathien (insbesondere Parästhesien), Myalgien, Haarausfall, gastrointestinale Nebenwirkungen (z. B. Übelkeit, Erbrechen, Durchfall).
Paclitaxel-Albumin
Paclitaxel steht als Arzneimittel gegen Krebs seit 1993 zur Verfügung. Herkömmliche Zubereitungsarten von Paclitaxel enthalten Substanzen, die zwar Paclitaxel lösen, die aber auch Überempfindlichkeitsreaktionen (allergische Reaktionen) verursachen können. Ein im Januar 2008 von der europäischen Zulassungsbehörde (European Medicines Agency, EMA) zugelassenes Paclitaxel (Handelsname Abraxane ®; Hersteller Celgene, ehemals Abraxis) enthält keine dieser Substanzen. [8]
Stattdessen wird das Paclitaxel in Abraxane® in das menschliche Protein Albumin in Form von winzigen Partikeln eingebunden, die auch als "Nanoteilchen oder Nanopartikel" bekannt sind. Daraus lässt sich leicht eine Suspension herstellen, die in eine Vene infundiert werden kann. Die Nanopartikel selbst bewirken auch eine bessere Verteilung des Wirkstoffs im Körper.[9]
Handelsnamen
Abraxane (D), Albraxane (A), Celltaxel (D), Ebetaxel (A), NeoTaxan (D), Paxene (A), Ribotax (D), Taxol (D, A, CH), Taxomedac (D), zahlreiche weitere Generika (D, A, CH) [10][11][12]
Siehe auch
Literatur
- Eckhard Leistner (2005): Die Biologie der Taxane. In: Pharmazie in unserer Zeit. Bd. 34, S. 98–103. doi:10.1002/pauz.200400108
- Hans-Peter Lipp & Carsten Bokemeyer (2005): Therapie solider Tumoren: Wirksamkeit und Toxizität der Taxane. In: Pharmazie in unserer Zeit. Bd. 34, S. 128–137. doi:10.1002/pauz.200400113
- Volker Bartsch (2004): Das Taxol-Buch, Thieme Verlag
Einzelnachweise
- ↑ Datenblatt Paclitaxel bei Acros, abgerufen am 20. Februar 2010.
- ↑ a b Datenblatt Paclitaxel bei Merck, abgerufen am 20. Februar 2010.
- ↑ Liggins et al. (1997): Solid-state characterization of paclitaxel. In: J. Pham. Sci. Bd. 86, S. 1458–1463; PMID 9423162.
- ↑ a b Datenblatt Paclitaxel bei Sigma-Aldrich, abgerufen am 16. April 2011.
- ↑ Paclitaxel bei ChemIDplus.
- ↑ Paclitaxel aus Fermentern. Pharmazeutische Zeitung, Ausgabe 34/2002, hier online.
- ↑ Wani, M. C.; Taylor, H. L.; Wall, M. E.; Coggon, P.; McPhail, A. T. J. Am. Chem. Soc. 1971, 93, 2325–2327.
- ↑ Summary of the European Public Assessment Report (EPAR) (englisch).
- ↑ Zusammenfassung der Merkmale des Arzneimttels (deutsch).
- ↑ Rote Liste Online, Stand: August 2009.
- ↑ Arzneimittelkompendium der Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.
Weblinks

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-L01
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Erbgutverändernder Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Alkaloid
- Zytostatikum
- Pflanzliches Gift
- Arzneistoff
- Carbonsäureester
- Benzamid
- Benzolcarbonsäureester
- Essigsäureester
- Alpha-Hydroxycarbonsäureester
- Aromat
- Cyclohexen
- Sauerstoffhaltiger gesättigter Heterocyclus
- Polyol
- Keton
- Cyclohexan
- Cycloalkan
- Cycloalkanol
Wikimedia Foundation.
