- Plerixafor
-
Strukturformel 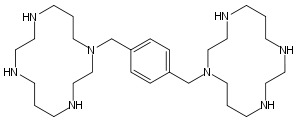
Allgemeines Freiname Plerixafor Andere Namen - IUPAC: 1-[4-(1,4,8,11-Tetrazacyclotetradec- 1-ylmethyl)phenyl]methyl]-1,4,8,11- tetrazacyclo-tetradecan
- AMD3100
- JM 3100
Summenformel C28H54N8 CAS-Nummer 155148-32-6 (Octahydrochlorid) PubChem 65015 ATC-Code L03AX16
Eigenschaften Molare Masse 502,79 g·mol−1 Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 22-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Plerixafor (auch: AMD3100 und JM3100) ist ein von der Firma Genzyme vermarkteter Arzneistoff aus der Gruppe der Bizyklame, der zur Freisetzung von Stammzellen in die Blutbahn und anschließender autologer Stammzelltransplantation eingesetzt wird. Plerixafor ist der erste von der US-amerikanischen Food and Drug Administration (FDA) zugelassene CXCR4-Hemmer, eine Zulassung für Europa besteht seit 2009.
Inhaltsverzeichnis
Geschichte
Plerixafor wurde zu Beginn der 1990er Jahre vom Johnson Matthey Technology Centre auf Grund seiner anti-HIV-Wirksamkeit entdeckt.[2] Nach dem Einstieg von Johnson Matthey bei der neu gegründeten AnorMED Inc. wurde für Plerixafor zunächst ein Einsatz in der HIV-Therapie angestrebt. Plerixafor zeigte in klinischen Studien eine Wirksamkeit gegen X4-trope HIV-1-Stämme nach parenteraler Gabe.[3] Auf Grund einer fehlenden oralen Bioverfügbarkeit des Arzneistoffs verbunden mit der daraus sich zwangsläufig ergebenden Notwendigkeit einer wenig populären parenteralen Verabreichung, wurde der angestrebte Einsatz als HIV-Therapeutikum auf Grund geringer Marktchancen verworfen. Plerixafor wurde im Jahr 2003 der Status eines Orphan-Arzneimittels verliehen. Im Dezember 2008 erfolgte die Zulassung des Plerixafor-Präparates Mozobil™ durch die amerikanische FDA[4], im Mai 2009 folgte die Europäische Arzneimittelagentur.
Chemie
Eigenschaften
Plerixafor ist eine stark basische chemische Verbindung mit acht protonierbaren Stickstoffatomen. Die Zyklamgruppen des Plerixafors sind in der Lage, stabile Komplexe mit zweiwertigen Metallionen, insbesondere Zink, Kupfer und Nickel sowie ferner auch mit Kobalt und Rhodium zu bilden. Unter physiologischen Bedingungen liegt Plerixafor auch als biologisch aktiver Zinkkomplex vor. Plerixafor kann somit als Prodrug seines Zinkkomplexes angesehen werden.[5]
Synthese
Die Synthese von Plerixafor ist als ein mehrstufiger Prozess beschrieben.[6] Initial werden drei der 4 Stickstoffatome des 1,4,8,11-Tetraazacyclotetradecans mit Tosylgruppen geschützt. Das so entstandene Tris-Tosyl-1,4,8,11-Tetraazacyclotetradecan wird mit p-Xylenglykol oder 1,4-Bis(Brommethyl)benzol in Gegenwart von Kaliumcarbonat in Acetonitril umgesetzt. Nach Abspaltung der Tosyl-Schutzgruppen mittels Bromwasserstoffsäure kann Plerixafor als Octahydrobromid isoliert werden.
Pharmakologie
Anwendungsgebiete
Plerixafor ist in den USA in Kombination mit G-CSF zur Freisetzung von Stammzellen aus dem Knochenmark in die Blutbahn zum Zweck der Stammzellisolierung für eine Stammzelltransplantation bei Patienten mit multiplen Myelom oder Non-Hodgkin-Lymphom zugelassen.[7]
Wirkmechanismus
Plerixafor wirkt als Antagonist auf den Chemokinrezeptor CXCR4. Dieser Rezeptor ist für die zielgerichtete Wanderung (Chemotaxis) von Stammzellen in Richtung höherer Konzentrationen des CXCR4-Liganden CXCL12 in das Knochenmark verantwortlich. Die Blockade des Rezeptors geschieht durch Anbindung von Plerixafor an oberflächennahe Teile der Ligandenbindungstasche von CXCR4 unter Beteiligung der die Bindungstasche umgebenden Transmembrandomänen I, II, IV, VI und VII.[8] Auf diese Weise blockiert Plerixafor das für die Rezeptorakivierung essenzielle Anbinden des N-terminalen Teils von CXCL12 in die Ligandenbindungstasche. Nachfolgende Signaltransduktionsvorgänge, die letztlich zu einer Migration von CXCR4-positiven Stammzellen und Lymphozyten zu höheren CXCL12-Konzentrationen hin führen, werden unterbrochen.
Gleichfalls hemmt die Einschleusung von X4-tropen HI-Viren in T-Zellen. Dies geschieht ebenfalls über die Blockade oberflächennaher Aminosäurereste von CXCR4, der wie der Chemokinrezeptor CCR5 eine HIV-Corezeptorfunktion besitzt, und somit einer Blockade der Andockstellen für das HIV-Kapsidprotein gp120. Eine arzneimittelrechtliche Zulassung für die Indikation HIV besteht jedoch nicht.
Gegenanzeigen
Plerixafor sollte nicht bei Patienten mit einer Leukämie eingesetzt werden, da Plerixafor die Freisetzung von leukämischen Zellen fördern kann.[7]
Schwangerschaft
Im Tierexperiment ist Plerixafor teratogen und fetotoxisch. Daher sollte eine Schwangerschaft vor der Plerixaforanwendung ausgeschlossen werden.[7]
Nebenwirkungen
Die häufigsten Nebenwirkungen einer Plerixaforanwendung sind mit einer Häufigkeit von über 10% Durchfall, Übelkeit, Erbrechen, Müdigkeit, Kopf- und Gelenkschmerzen sowie Reaktionen an der Injektionsstelle. Darüber hinaus sind Blutbildveränderungen mit einem Anstieg der Leukozytenzahl und einer Verringerung der Thrombozytenzahl und eine mögliche Mobilisierung von Tumorzellen aus dem Knochenmark zu erwarten. Tierversuche weisen darüber hinaus auf eine mögliche Gefahr einer Milzruptur.[7]
Wechselwirkungen
Wechselwirkungen mit anderen Arzneistoffen sind derzeit noch nicht bekannt. Plerixafor ist kein Inhibitor des Cytochrom-P450-Enzymsystems.[7]
Einzelnachweise
- ↑ Datenblatt AMD3100 octahydrochloride hydrate bei Sigma-Aldrich, abgerufen am 11. August 2008.
- ↑ De Clercq E, Yamamoto N, Pauwels R, et al: Highly potent and selective inhibition of human immunodeficiency virus by the bicyclam derivative JM3100. In: Antimicrob. Agents Chemother.. 38, Nr. 4, April 1994, S. 668–674. PMID 7913308. Volltext bei PMC: 284523.
- ↑ Hendrix CW, Flexner C, et al.: Pharmacokinetics and safety of AMD-3100, a novel antagonist of the CXCR-4 chemokine receptor, in human volunteers. Antimicrob Agents Chemother. 2000 Jun;44(6):1667–1673 PMID 10817726
- ↑ http://www.genzyme.com/corp/media/GENZ%20PR-121508.asp - Pressemitteilung von Genzyme über die FDA-Zulassung von Mozobil
- ↑ Esté JA, Cabrera C, De Clercq E, Struyf S, Van Damme J, Bridger G, Skerlj RT, Abrams MJ, Henson G, Gutierrez A, Clotet B, Schols D: Activity of different bicyclam derivatives against human immunodeficiency virus depends on their interaction with the CXCR4 chemokine receptor. In: Mol. Pharmacol.. 55, Nr. 1, Januar 1999, S. 67–73. PMID 9882699.
- ↑ Bridger G. et al. (1993). LINKED CYCLIC POLYAMINES WITH ACTIVITY AGAINST HIV. WO/1993/012096
- ↑ a b c d e http://www.genzyme.com/corp/investors/Mozobil_PI.pdf - US prescribing information von Mozobil (en)
- ↑ Wong RS, Bodart V, Metz M, Labrecque J, Bridger G, Fricker SP: Comparison of the potential multiple binding modes of bicyclam, monocylam, and noncyclam small-molecule CXC chemokine receptor 4 inhibitors. In: Mol. Pharmacol.. 74, Nr. 6, Dezember 2008, S. 1485–1495. doi:10.1124/mol.108.049775. PMID 18768385.
Kategorien:- ATC-L03
- Arzneistoff
- Benzylamin
- Stickstoffhaltiger gesättigter Heterocyclus
Wikimedia Foundation.
