- Squalen
-
Strukturformel 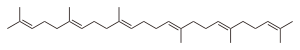
Allgemeines Name Squalen Andere Namen - 2,6,10,15,19,23-Hexamethyl- 2,6,10,14,18,22-tetracosahexaen
- Spinacen
- Supraen
Summenformel C30H50 CAS-Nummer 111-02-4 PubChem 638072 Kurzbeschreibung farblose, ölige Flüssigkeit mit schwachem Geruch[1]
Eigenschaften Molare Masse 410,71 g·mol−1 Aggregatzustand flüssig
Dichte 0,86 g·cm−3[1]
Schmelzpunkt Siedepunkt 275 °C[1]
Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Squalen (mit Betonung auf der letzten Silbe Squalen), Summenformel: C30H50, ist eine organische, ungesättigte Verbindung aus der Gruppe der Triterpene, die von allen höheren Organismen produziert wird. Der Stoff spielt auch im menschlichen Stoffwechsel eine Rolle.[4]
Inhaltsverzeichnis
Geschichte
Squalen wurde 1906 von Mitsumaru Tsujimoto entdeckt und als chemische Substanz isoliert.[5] Er benannte es nach Squalus, lateinisch für Haifisch. Squalen wurde in hohen Konzentrationen in Extrakten des Haifischleberöls entdeckt. Die systematische medizinische Forschung wurde erst 1930 durch Keijiro Kogami von der Tokyo Imperial University angestoßen.
Nobelpreisträger Paul Karrer verifizierte 1931 die exakte chemische Struktur des Squalens durch Totalsynthese.[6][7]
Natürliches Vorkommen
Squalen ist in der Natur weit verbreitet, da es in allen höheren Lebewesen und damit auch im Menschen vorkommt. Es ist ein wesentlicher Bestandteil der Hautlipide[8] und kommt ebenfalls im menschlichen Blutserum vor.[9] Die natürliche Menge von körpereigenem Squalen im menschlichen Blut beträgt etwa 250 ng/ml.[10][11]
Squalen kommt in verschiedenen Lebensmitteln in hohen Konzentrationen vor, beispielsweise in Ziegenmilch[12] und in vielen pflanzlichen Ölen wie Olivenöl (0,1–0,7 %), Weizenkeimöl oder Reisöl (unter 0,03 %). Das Hauptvorkommen sind allerdings Fischöle. Am höchsten ist er in Lebertran verschiedener Haie (40–90 %), doch auch in vielen anderen Fischölen ist es in hohem Anteil (bis zu 30 %) enthalten[13]
Eigenschaften und biologische Wirkung
Squalen ist eine farblose, ölige Flüssigkeit, die aufgrund ihres ungesättigten Charakters aus der Luft Sauerstoff aufnimmt und leicht polymerisiert. Es ist nahezu unlöslich in Wasser, aber gut löslich in Aceton, Ether, Petrolether und anderen unpolaren Lösungsmitteln.[14] Squalen ist ein Antioxidans[15] und kann im Gegensatz zu den meisten anderen Antioxidantien in höheren Konzentrationen im Körper gespeichert werden. So können beispielsweise Lycopene und Ubichinon nicht auf hohem Niveau im menschlichen Körper gespeichert werden, da sie bereits bei Konzentrationen von mehr als 10 µM toxisch wirken, während Squalen selbst bei 100 µM nicht toxisch wirkt.[16]
Verwendung
Squalen wird industriell zu Squalan hydriert, das als Salbengrundlage, aber auch als Schmiermittel und Transformatorenöl Verwendung findet.[14]
Squalen ist Bestandteil von Adjuvanzien wie zum Beispiel AS03 und MF59, die als Wirkverstärker Impfstoffen zugesetzt werden.[17][18] Squalenhaltige Adjuvanzien sind beispielsweise in den Impfstoffen Pandemrix oder Celtura enthalten, die in Deutschland zur Eindämmung der Pandemie H1N1 2009 im Rahmen der Schweinegrippe-Impfung eingesetzt wurden.
In der Alternativmedizin wird Haifischleberöl als Mittel gegen Krebserkrankungen und gegen das atopische Ekzem verwendet. Für die Verwendung des Haifischleberöls oder eines seiner Bestandteile als Therapeutikum liegen derzeit keine ausreichenden Belege in Form von klinischen Studien vor – experimentelle Arbeiten an Tieren weisen aber auf eine mögliche Wirksamkeit hin.[19]
Biosynthese
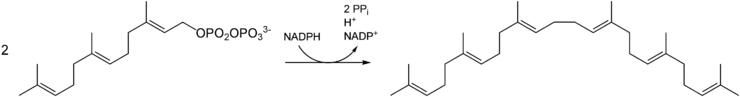
Squalen wird ausgehend von Isopentenylpyrophosphat durch eine Reihe von Kondensationsreaktionen synthetisiert. Dabei entsteht zunächst Geranylpyrophosphat, dieses kondensiert dann mit Isopentenylpyrophosphat zu Farnesylpyrophosphat. Alle Kondensationen katalysiert die Geranyltransferase. Zwei Moleküle Farnsylpyrophosphat werden schließlich unter NADPH-Verbrauch zu Squalen verknüpft, was durch die Squalensynthase im endoplasmatischen Retikulum katalysiert wird.
Funktion
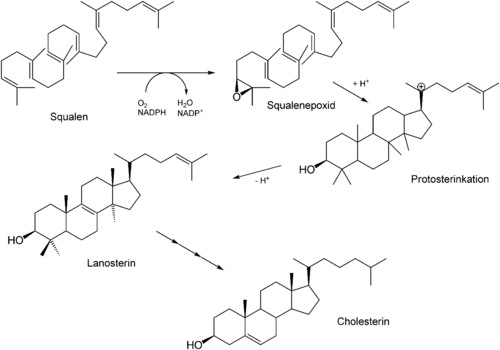
Squalen wird für die Synthese aller zyklischen Triterpene und Steroide als Zwischenstufe gebildet[14], etwa in der Biosynthese von Cholesterin, Steroiden (Hormonen wie u.a. Östrogene, Testosteron, Kortisol) und Vitamin D. Dabei wird Squalen zunächst durch eine Monooxygenase unter NADPH-Verbrauch aktiviert, es entsteht Squalenepoxid (2,3-Oxidosqualen). Dieses wird schließlich durch die Oxidosqualen-Zyklase in Lanosterin zyklisiert. Durch eine Reihe nachfolgender Reaktionen entsteht schließlich Cholesterin.
Gesundheitliche Kontroverse
Aufgrund seiner aktivierenden Wirkung auf das Immunsystem wurde oft vermutet, dass Squalen unter bestimmten Bedingungen Autoimmunkrankheiten auslösen oder deren Entwicklung begünstigen zu können. Unter anderem wurde Squalen mit dem Golfkriegs-Syndrom in Verbindung gebracht, da es vermeintlich in dem Anthrax-Impfstoff enthalten war, mit welchem am Golfkrieg 1991 beteiligte amerikanische Soldaten vor dem möglichen Einsatz biologischer Waffen geschützt werden sollten.
Der Zusammenhang zwischen Squalen und Golfkriegs-Syndrom wird in erster Linie auf eine Studie aus dem Jahr 2000 von Asa et al. mit 144 Golfskriegsveteranen zurückgeführt. Die Ergebnisse dieser Studie besagen, dass bei 95% der untersuchten am Golfkriegs-Syndrom erkrankten Veteranen und bei 0 % (< 0.001 %) der nicht erkrankten Veteranen Antikörper gegen Squalen festgestellt wurden, was als Hinweis auf einen Zusammenhang zwischen Squalen und Symptomen gewertet wurde.[20] Allerdings schließt die Studie mit der Aussage: "Es ist wichtig zu beachten, dass wir in unseren Untersuchungen keinen Beweis dafür finden konnten, dass Squalen als Adjuvans in den Impfstoffen für militärisches oder sonstiges Personal verwendet wurde." Anschließende Untersuchungen stellten zudem gravierende methodische Mängel in der Studie fest.[21]
In einer im Jahr 2002 veröffentlichten Studie betonten Asa et al. erneut einen Zusammenhang zwischen Squalen-Antikörpern und den Symptomen des Golfkriegs-Syndroms, welcher tatsächlich auf die Gegenwart von Squalen in einigen der Impfdosen zurückzuführen sei.[22] Andere Studien zeigten jedoch, dass die verwendeten Impfstoffe kein Squalen als Wirkverstärker enthielten.[23][24] Zwar wurden mit einer verbesserten Analysemethode später in einer einzigen Flasche (Bezeichnung FAV008) von 44 Flaschen aus insgesamt 38 Chargen geringfügige Spuren (80 ng/ml) Squalen festgestellt.[22] Allerdings wurde diese nicht als Adjuvanz zugesetzt, sondern ist vermutlich das Resultat von Verunreinigungen durch Fingerabdrücke auf unzureichend gereinigten Laborgeräten.[25][26]
Spätere Studien widerlegten einen Zusammenhang zwischen Squalen und dem Golfkriegs-Syndrom[27][28] und stellten fest, dass unabhängig von Impfungen viele Menschen Squalen-Antikörper im Blut haben.[29]
Neben dem Golfkriegs-Syndrom wurde die Injektion von Squalen ins Gewebe mit verschiedenen anderen Autoimmunerkrankungen in Verbindung gebracht. Im Tierversuch wurde in einem gegenüber Autoimmunerkrankungen besonders anfälligen Rattenstamm nach intradermaler Injektion von reinem Squalen die Entwicklung einer Arthritis beobachtet.[30] In einer Studie an gesunden Mäusen wurde nach intraperitonealer Injektion von Squalen und Pristan, einer ähnlichen Substanz, die Bildung von für die Autoimmunerkrankung Lupus erythematodes typischen Autoantikörpern nachgewiesen.[31]
Eine epidemiologische Analyse der Daten zur Sicherheit des squalenhaltigen saisonalen und pandemischen Influenzaimpfstoffs MF59 ergab allerdings keine Hinweise auf ein erhöhtes Risiko für Nebenwirkungen autoimmuner Herkunft im Menschen.[32]
Seit 1997 (in Deutschland seit 2000) wurde Squalen als Bestandteil des Impfstoffes Fluad gegen die saisonale Grippe in über 40 Millionen Dosen verabreicht, ohne dass bisher nennenswerte Nebenwirkungen bekannt wurden.[27][23]
Einzelnachweise
- ↑ a b c d e Datenblatt Squalen bei Merck, abgerufen am 8. Juni 2010.
- ↑ J. Ernst , J.-H. Fuhrhop: Die Kristallstruktur des Squalens. In: Liebigs Annalen der Chemie. 1979, 11, S. 1635–1642, doi:10.1002/jlac.197919791102.
- ↑ a b T. Yamaguchi, M. Nakagawa, K. Hidaka, T. Yoshida, T. Sasaki, S. Akiyama, M. Kuwano: Potentiation by squalene of antitumor effect of 3-((4-amino-2-methyl-5-pyrimidinyl)methyl)-1-(2-chloroethyl)-nitrosourea in a murine tumor system. In: Japanese Journal of Cancer Research: GANN. 1985, 76, 10, S. 1021–1026, PMID 3935620.
- ↑ J.M. Berg, J.L. Tymoczko, L. Stryer: Biochemie. 5. Auflage, Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 978-3-8274-1303-1.
- ↑ W. Eltringham, O. Catchpole: Processing of Fish Oils by Supercritical Fluids. In: José Luis Martinez: Supercritical Fluid Extraction of Nutraceuticals and Bioactive Compounds. CRC Press, Boca Raton 2007, ISBN 978-0-8493-7089-2, S. 144.
- ↑ P.J.T. Morris, A.S. Travis, C. Reinhardt: Research Fields and Boundaries in Twentieth-Century Organic Chemistry. In: Carsten Reinhardt: Chemical sciences in the 20th century: bridging boundaries. 1. Auflage, Wiley-VCH, Weinheim 2001, ISBN 978-3-527-30271-0, S. 35.
- ↑ Paul Karrer: Lehrbuch der Organischen Chemie. 3. Auflage, G. Thieme, Stuttgart 1933, S. 60.
- ↑ S .Ekanayake Mudiyanselage, M. Hamburger, J.J. Thiele: Ultraviolet A Induces Generation of Squalene Monohydroperoxide Isomers in Human Sebum and Skin Surface Lipids In Vitro and In Vivo. In: Journal of Investigative Dermatology. 2003, 120, 6, S. 915-922, doi:10.1046/j.1523-1747.2003.12233.x.
- ↑ Sabine Junglas: Der Einfluss vegetarischer Ernährung auf die unverseifbaren Lipidkomponenten des Humanserums. Dissertation TU Berlin, 1988.
- ↑ T.A. Miettinen: Diurnal variation of cholesterol precursors squalene and methyl sterols in human plasma lipoproteins. In: Journal of Lipid Research. 1982, 23, 3, S. 466-473, PMID 7200504.
- ↑ K. Nikkilä, T.A. Miettinen: Serum and hepatic cholestanol, squalene and noncholesterol sterols in man: A study on liver transplantation. In: Hepatology. 1992, 15, 5, S. 863-870, PMID 1568728.
- ↑ J. Cerbulis, V.P. Flanagan, H.M. Farrell Jr.: Composition of the hydrocarbon fraction of goats' milk. In: Journal of Lipid Research. 1985, 26, 12, S. 1438-1443, PMID 4086946.
- ↑ Squalen. In: wissenschaft-online Lexikon der Ernährung.
- ↑ a b c Squalen. In: wissenschaft-online Lexikon der Biologie.
- ↑ Rao MK Govind, KT. Achaya: Antioxidant activity of squalene. In: Journal of the American Oil Chemists' Society. 1986, 45, 4, S. 296, doi:10.1007/BF02652431.
- ↑ Medizinisches Implantat enthaltend eine antioxidative Substanz. PatentDE, 14. April 2011, abgerufen am 1. August 2011.
- ↑ Paul-Ehrlich-Institut: Zusammensetzung der Adjuvanzien MF59 und AS03. Fachliche Information für Ärzte und Apotheker: Pandemie-Impfstoffe in der Schwangerschaft, eingesehen am 8. Juni 2010.
- ↑ Dagmar Jäger-Becker: Adjuvantien stärken Grippe-Impfstoffe. Ärzte Zeitung, eingesehen am 8. Juni 2010.
- ↑ W.B. Szostak, D. Szostak-Wegierek: Health properties of shark oil. In: Przegla̧d lekarski. 2006, 63, 4, S. 223-226 PMID 17083160 (Polnisch)
- ↑ P.B. Asa, Y. Cao, R.F. Garry: Antibodies to Squalene in Gulf War Syndrome. In: Experimental and Molecular Pathology. 2000, 68, 1, S. 55-64, PMID 10640454.
- ↑ United States Department of Defense: Armed Forces Epidemilogy Board (AFEB) Recommendations Regarding Review of the Paper, »Antibodies to Squalene in Gulf War Syndrome by P. B. Asa, Y. Cao and R. F. Garry, eingesehen am 9. Juni 2010.
- ↑ a b P.B. Asa, R.B. Wilson, R.F. Garry: Antibodies to Squalene in Recipients of Anthrax Vaccine. In: Experimental and Molecular Pathology. 2002, 73, 1, S. 19-27, PMID 12127050.
- ↑ a b Global Advisory Committee on Vaccine Safety, World Health Organization: Squalene-based adjuvants in vaccines. 21. Juli 2006, eingesehen am 8. Juni 2010.
- ↑ R.J. Spanggord, B. Wu, M. Sun, P. Lim, W.Y. Ellis: Development and application of an analytical method for the determination of squalene in formulations of anthrax vaccine adsorbed. In: Journal of Pharmaceutical and Biomedical Analysis. 2002, 29, 1-2, S. 183-193, PMID 12062677.
- ↑ Food and Drug Administration: Q&A: The Facts on Squalene, 3. Juli 2005, eingesehen am 9. Juni 2010 (pdf).
- ↑ K.G. Asano, C. K. Bayne, K.M. Horsman, M.V. Buchanan: Chemical composition of fingerprints for gender determination. In: Journal of Forensic Science. 2002, 47, 4, S. 805–807, PMID 12136987.
- ↑ a b Paul-Ehrlich-Institut: Stellungnahme zu Risiken, die im Zusammenhang mit Squalen diskutiert werden: Squalen bzw. Squalen-Antikörper als angebliche Auslöser für das 'Gulf war syndrome', 12. November 2009, eingesehen am 8. Juni 2010.
- ↑ C.J. Phillips, G.R. Matyas, C.J. Hansen, C.R. Alving, T.C. Smith, M.A. Ryan: Antibodies to squalene in US Navy Persian Gulf War veterans with chronic multisymptom illness. In: Vaccine. 2009, 27, 29, S. 3921-3926, PMID 19379786.
- ↑ G.R. Matyas, M. Rao, P.R. Pittman, R. Burge, I.E. Robbins, N.M. Wassef, B. Thivierge, C.R. Alving: Detection of antibodies to squalene: III. Naturally occurring antibodies to squalene in humans and mice. In: Journal of Immunological Methods. 2004, 286, 1-2, S. 47-67, PMID 15087221.
- ↑ B.C. Carlson, A.M. Jansson, A. Larsson, A. Bucht, J.C. Lorentzen: The Endogenous Adjuvant Squalene Can Induce a Chronic T-Cell-Mediated Arthritis in Rats. In: American Journal of Pathology. 2000, 156, 6, S. 2057-2065, PMID 10854227.
- ↑ M. Satoh, Y. Kuroda, H. Yoshida, K.M. Behney, A. Mizutani, J. Akaogi, D.C. Nacionales, T.D. Lorenson, R.J. Rosenbauer, W.H. Reeves: Induction of lupus autoantibodies by adjuvants. In: Journal of Autoimmunity. 2003, 21, 1, S. 1-9, PMID 12892730.
- ↑ M. Pellegrini, U. Nicolay, K. Lindert, N. Groth, G. Della Cioppa: MF59-adjuvanted versus non-adjuvanted influenza vaccines: Integrated analysis from a large safety database. In: Vaccine. 2009, 27, 49, S. 6959-6965, PMID 19751689.
Kategorien:- Stoffwechselintermediat
- Terpen
- Polyen
- Steroidhormonbiosynthese
Wikimedia Foundation.