- Stickstoff(II)-fluorid
-
Strukturformel 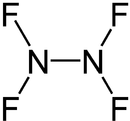
Allgemeines Name Stickstoff(II)-fluorid Andere Namen - Distickstofftetrafluorid
- Tetrafluorhydrazin
Summenformel N2F4 CAS-Nummer 10036-47-2 Kurzbeschreibung farbloses Gas[1]
Eigenschaften Molare Masse 104,01 g·mol−1 Aggregatzustand gasförmig
Dichte 4,6 kg·m−3[2]
Schmelzpunkt Siedepunkt −73 °C[1]
Dampfdruck Sicherheitshinweise EU-Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stickstoff(II)-fluorid, auch Distickstofftetrafluorid, ist eine chemische Verbindung der Elemente Stickstoff und Fluor mit der Summenformel N2F4. Stickstoff hat hier die Oxidationsstufe +2. Die Verbindung zählt zur Gruppe der Stickstoffhalogenide.
Inhaltsverzeichnis
Darstellung
Stickstoff(II)-fluorid kann durch Reduktion von Stickstofftrifluorid synthetisiert werden. Hierzu wird es in einer Redox-Reaktion bei erhöhter Temperatur mit einem Metall, beispielsweise Kupfer, das zu Kupfer(I)-fluorid oxidiert wird, umgesetzt.[1]
Eigenschaften
Es handelt sich bei Raumtemperatur um ein farbloses Gas, das bei −73 °C kondensiert und bei −164,5 °C erstarrt.
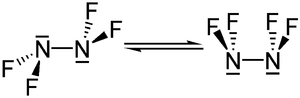
Zwei Konformere liegen im Gleichgewicht vor, die gauche- und die trans-Form. Analog zu Hydrazin ist die trans-Form, bei der die Fluoratome auf Lücke stehen, energetisch - in diesem Fall um etwa 2 kJ·mol−1 - günstiger. Die Inversionsbarriere zwischen beiden Konformationen beträgt 12,5 kJ·mol−1.[1]
Die Bindungslänge zwischen den Stickstoffatomen beträgt 148 pm, die N-F-Bindungslänge 139 pm.[1]
Stickstoff(II)-fluorid ist sehr reaktiv und ein starkes Fluorierungsmittel. Die N-N-Einfachbindung ist infolge der -I-Effekte durch die Fluorsubstituenten leicht radikalisch spaltbar. Mit brennbaren Stoffen wie Wasserstoff kann es heftig reagieren. Hydrolytisch ist es weniger stabil als Stickstofftrifluorid.
Verwendung
Stickstoff(II)-fluorid oxidiert elementares Lithium zu Lithiumfluorid und -nitrid.
Einzelnachweise
- ↑ a b c d e f Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ Stickstoff(II)-fluorid bei weblements.com
- ↑ Eintrag zu Stickstoff(II)-fluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27.10.2008 (JavaScript erforderlich)
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Wikimedia Foundation.