- Lithiumnitrid
-
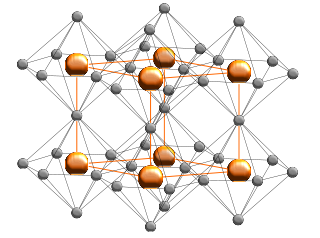
Kristallstruktur 
Allgemeines Name Lithiumnitrid Verhältnisformel Li3N CAS-Nummer 26134-62-3 Kurzbeschreibung rotbrauner Feststoff mit ammoniakartigem Geruch[1]
Eigenschaften Molare Masse 34,83 g·mol–1 Aggregatzustand fest
Dichte 1,38 g·cm–3 [1]
Schmelzpunkt Löslichkeit reagiert heftig mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 260-314 EUH: keine EUH-Sätze P: 223-231+232-280-305+351+338-370+378-422 [2] EU-Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 11-14-34 S: 8-20-26-30-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumnitrid, Li3N, ist eine chemische Verbindung, die aus Lithium und Stickstoff aufgebaut ist.
Inhaltsverzeichnis
Synthese
Lithiumnitrid wird durch Reaktion von Lithium mit Stickstoff hergestellt. Die Reaktion läuft schon bei Raumtemperatur ab, jedoch sehr langsam, so dass zur Synthese von Lithiumnitrid meist höhere Temperaturen verwendet werden:[3]
Struktur
Im Lithiumnitrid bilden die Lithiumatome graphitähnliche hexagonale Ringe, in deren Zentrum sich ein Stickstoffatom befindet. Weitere Lithiumatome befinden sich oberhalb und unterhalb des Stickstoffkerns, so dass jeder Stickstoff in einer hexagonal-bipyramidalen Geometrie von acht Lithiumkernen umgeben ist.[3][4]
Eigenschaften
Physikalische Eigenschaften
Lithiumnitrid ist ein feines, rot-braunes Pulver mit einer Dichte von 1,38 g·cm-3 bei Standardbedingungen. Es schmilzt bei 845 °C und ist unter Ausschluss von Feuchtigkeit und Luft stabil.[5] Lithiumnitrid ist ein guter Ionenleiter.[6]
Die Bildungsenthalpie von Lithiumnitrid beträgt -207 kJ/mol.[7]
Chemische Eigenschaften
Lithiumnitrid ist eine Superbase, da das N3−-Ion stark basisch reagiert. Mit Wasser hydrolysiert Lithiumnitrid zu Lithiumhydroxid und Ammoniak.[3]
Beim Erhitzen im Wasserstoffstrom bildet sich Lithiumhydrid.[8] Als Zwischenstufen entstehen Lithiumamid (LiNH2) und Lithiumimid (Li2NH).[9]
Beim Erhitzen von Lithiumnitrid mit Metallchloriden bilden sich Lithiumchlorid und das betreffende Metallnitrid.[8]
Verwendung
In der Metallurgie wird Lithiumnitrid zum Einbringen von Stickstoff in Legierungen verwendet.[10]
Forscher der National University of Singapore entdeckten, dass Lithiumnitrid bis zu 9,3 % Wasserstoff aufnehmen kann. Dabei werden die Wasserstoffatome ins Kristallgitter des Nitrids eingelagert. Für eine Anwendung sind allerdings die notwendigen Temperaturen von 255 °C noch zu hoch.[11][12]
Einzelnachweise
- ↑ a b c d e Datenblatt Lithiumnitrid bei AlfaAesar, abgerufen am 15. Dezember 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Lithium nitride bei Sigma-Aldrich, abgerufen am 8. April 2011.
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1153.
- ↑ Struktur von Li3N.
- ↑ Daten zu Lithiumnitrid bei Chemetalllithium.com.
- ↑ Definition: Superionenleiter - Meyers Lexikon online. web.archive.org. Abgerufen am 2. April 2009.
- ↑ M. Guntz: "Sur l'azoture de lithium" in Compt. Rend. Hebd. 1896, 123, S. 995-997. Volltext
- ↑ a b R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 134. Volltext
- ↑ K. A. Hofmann: "Lehrbuch der anorganischen Chemie", 2. Auflage 1919. Verlag F. Vieweg & Sohn, S. 441. Volltext
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 9780849386718, S. 228.
- ↑ Bericht bei Wissenschaft.de.
- ↑ Bericht bei Innovations-Report.de.
Wikimedia Foundation.