- Sudsalz
-
Kristallstruktur 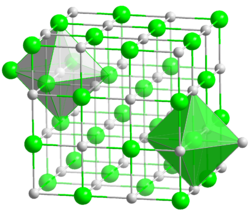
__ Na+ __ Cl- Kristallsystem kubisch Raumgruppe 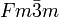
Gitterkonstanten a = 562 pm[1] Koordinationszahlen Na[6], Cl[6] Allgemeines Name Natriumchlorid Andere Namen - Kochsalz
- Halit
Verhältnisformel NaCl CAS-Nummer 7647-14-5 ATC-Code Eigenschaften Molare Masse 58,442 g·mol−1 Aggregatzustand fest
Dichte 2,17 g·cm−3 (20 °C)[2]
Schmelzpunkt 801 °C[2]
Siedepunkt 1465 °C[2]
Löslichkeit gut in Wasser (359 g·l−1 bei 20 °C[3])
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumchlorid (Kochsalz) ist das Natriumsalz der Salzsäure mit der chemischen Formel NaCl.
Natriumchlorid ist in der Natur in großer Menge vorhanden, größtenteils gelöst im Meerwasser mit einem Gehalt von ca. 3 %, insgesamt 3,6 × 1016 Tonnen,[4] außerdem als Mineral Halit mit einem Gehalt von bis zu 98 % in den häufigen Steinsalzlagerstätten, die in erdgeschichtlicher Zeit in austrocknenden Meeresbuchten sedimentierten. Steinsalzschichten sind plastisch und werden neben anderen geologischen Prozessen, denen sie unterliegen, vielfach verformt, u. a. zu leichter abbaubaren Salzstöcken und Salzkissen. Wenn eine Salzlagerstätte im Gebirge an die Oberfläche austritt, kann sogar ein Salzgletscher entstehen. Allein die unterirdischen Salzvorkommen in Deutschland werden auf etwas mehr als 100.000 Kubikkilometer geschätzt.
Da Natriumchlorid der wichtigste Mineralstoff für Menschen und Tiere ist (der menschliche Körper besteht zu etwa 0,9 % aus Salz und verliert davon täglich 3–20 Gramm), wurde es schon in vorgeschichtlicher Zeit gewonnen und blieb lange Zeit ein teures Handelsgut.
Inhaltsverzeichnis
Gewinnung
Natriumchlorid wird in großem Umfang aus den beiden Hauptvorkommen Steinsalz und Meersalz gewonnen. Salz aus oberirdischen Lagerstätten, z. B. Salzseen, hat nur geringe Bedeutung. Die Weltsalzproduktion betrug 2006 über 250 Millionen Tonnen, die Anteile an Stein- und Meersalz werden auf ca. 70 % bzw. 30 % geschätzt. Die sechs größten Produzenten 2006 mit zusammen über 60 % der Produktion sind in der unten stehenden Tabelle angegeben. China steigerte seine Produktion in den letzten Jahren erheblich, die USA hatten noch bis 2005 die größte Förderung. Die EU produziert insgesamt ähnlich viel wie die USA.
In Salzbergwerken, unter denen Tagebaue heute von quantitativ geringer Bedeutung sind, wird Steinsalz entweder bohrend-sprengend, schneidend oder nass abgebaut. In den ersten beiden Fällen wird das noch unter Tage mit Brechern zerkleinerte Material in verschiedenen Korngrößen zu Tage gefördert. Beim nassen Abbau (engl. Liquid Mining) wird ebenso wie bei der ausschließlich von über Tage betriebenen Bohrlochaussolung das Salz mittels Bohrspülwerken, historisch auch in Sinkwerken, in Wasser gelöst und in einer gesättigten Sole von 26,5 % zu Tage gefördert. Dies erlaubt auch die Nutzung stark verunreinigter Vorkommen. Bei natürlichem Wasserdurchtritt durch die salzführende Schicht kann auch natürliche Sole zu Tage treten, die meist jedoch untersättigt ist. Dies ist eine der historisch ältesten Salzquellen im Binnenland. Die Konzentration wurde früher zunächst mittels Gradierwerken erhöht, heute wird bergmännisch trocken abgebautes Salz zugesetzt. Aus der gereinigten Sole, die auch noch aus trocken abgebautem Steinsalz hergestellt werden kann, kann durch Eindampfen Siedesalz von großer Reinheit erzeugt werden. Heute geschieht dies mittels in Kaskaden angeordneter geschlossener Vakuumverdampfer, wodurch ein Großteil der eingesetzten Wärme zurückgewonnen werden kann. In klimatisch geeigneten Gebieten wird zunehmend auch Sonnenenergie zur Verdunstung genutzt, das Verfahren ist vergleichbar dem der Meersalzgewinnung.
Die Gewinnung von Salz aus Meerwasser ist nur in Küstengebieten mit hoher Sonneneinstrahlung bei gleichzeitig geringen Niederschlägen wirtschaftlich. Das Meerwasser wird hierzu durch als Salzgärten bezeichnete flache Beckenkaskaden geführt, in denen die Salzkonzentration durch natürliche Verdunstung zunimmt. Schließlich wird das ausgefällte Salz zusammengeschoben und getrocknet, nur für die seltene und teure Speisesalzqualität fleur de sel wird es an der Oberfläche schwimmend abgeschöpft. Auch in Salzgärten kann Sole entnommen werden.
Die vier Grundprodukte der Salzindustrie sind Sole, Steinsalz, Meersalz und Siedesalz. Für die USA schätzte der U.S. Geological Survey für 2007 mittlere Preise ab Werk von 10 USD/t für Sole, 25 USD/t für Steinsalz, 57 USD/t für Salz aus solarer Verdunstung und 150 USD/t für Siedesalz.[5]
Salzproduktion 2006 in Millionen Tonnen[6] Steinsalz Sole Siedesalz Meersalz gesamt China keine Angaben 54,0 USA 17,9 21,2 6,91 46,0 Indien 0,002 4,92 13,2 18,1 Deutschland 9,3 7,2 1,0 0 17,5 Kanada 11,5 1,93 0 13,4 Australien keine Angaben 11,4 … … … … … … Österreich 0,001 0,764 0 0,77 Schweiz keine Angaben 0,54 Welt 255,6 1„evaporated salt“, untergliedert in „pan salt“ (ca. 3,7; Siedesalz) und „solar salt“ (ca. 3,2; enthält u .a. Meersalz)[7]
2andere außer Stein- und Meersalz, hauptsächlich aus Aussolung von Steinsalz-Lagerstätten sowie aus Salzseen, auch solar
3andere einschließlich Sole
4Siedesalz nicht getrennt ausgewiesenEigenschaften
Thermodynamik Parameter Wert ΔfH0g −181,42 kJ/mol ΔfH0l −385,92 kJ/mol ΔfH0s −411,12 kJ/mol ΔfH0aq −407 kJ/mol S0g, 1 bar 229,79 J/(mol·K) S0l, 1 bar 95,06 J/(mol·K) S0s 72,11 J/(mol·K) Natriumchlorid bildet farblose Kristalle, die eine Natriumchlorid-Struktur ausbilden. Diese Kristalle sind, im Gegensatz zu vielen anderen Kristallen, nicht doppelbrechend. Hierbei ist jeder Natrium- sowie jeder Chlorkern oktaedrisch vom jeweils anderen Kern umgeben. Es ist sehr gut wasserlöslich. Natriumchlorid besitzt den typischen Salzgeschmack.
Die wässrige Lösung sowie die Schmelze leiten auf Grund der (elektrolytischen bzw. thermischen) Dissoziation von Natriumchlorid in seine Ionen elektrischen Strom, reines kristallines Natriumchlorid hingegen nicht.
Mit einem Gehalt von 23,3 % Natriumchlorid in wässriger Lösung bildet es ein eutektisches Gemisch. Dieses erstarrt am eutektischen Punkt von −21,3 °C homogen und ohne Entmischung. Diese Lösung wird Kryohydrat genannt.
Verwendung
Als Speisesalz ist Natriumchlorid schon seit Alters her ein wichtiger Bestandteil der menschlichen Ernährung. Es wird zum Würzen von fast allen Speisen benutzt. Seit der Zeit der Industrialisierung spielt jedoch mengenmäßig die industrielle Verwendung die weitaus größere Rolle. Je nach der Anwendung werden unterschiedliche Zusatzstoffe beigemischt.
Nach der Verwendung wird unterschieden zwischen Industriesalz als Rohstoff der chemischen Industrie, Auftausalz für winterlichen Straßendienst, Gewerbesalz für die verschiedensten industriellen und gewerblichen Zwecke und Speisesalz zum menschlichen Genuss. Die Anteile dieser Verwendungen sind für Deutschland und die USA in der folgenden Tabelle angegeben:
Industriesalz Auftausalz Gewerbesalz Speisesalz unbekannt Deutschland 80 % 12 % 5 % 3 % 0 USA (2007) 39 % 37 % 12 %* 3 % 9 % *weiter differenziert in 7 % (nichtchemische) industrielle, 3 % agrarische Verwendung und 2 % Regeneriersalz
Industriesalz
Als Industriesalz wird nur das in der chemischen Grundstoffindustrie eingesetzte Salz bezeichnet. Salz ist strategischer Rohstoff der chemischen Industrie und Grundlage für mehrere Tausend Produkte. Natriumchlorid wird dazu im Wesentlichen in zwei Verfahren für die Produktion von wichtigen Grundstoffen verwendet. Beim hierzu verwendeten Industriesalz handelt es sich in großem Umfang um Sole, die teilweise in Pipelines transportiert wird, im Übrigen um Steinsalz, bei entsprechenden lokalen Marktverhältnissen, wie etwa in Indien, auch um Meersalz. Für die USA wird der Soleanteil mit 90 % angegeben.
- Chloralkali-Elektrolyse: Produkte sind Chlor und Natronlauge. Weitere Produkte werden u. a. durch die Chlorchemie hergestellt , außerdem durch die Anwendungen des Natriumhydroxids.
- Solvay-Verfahren: Produkte sind Natriumcarbonat und Natriumhydrogencarbonat. Soda wird u. a. beim Schmelzen von Quarzsand als Glasrohstoff benötigt, zur Herstellung von Farbstoffen und Wasch- und Reinigungsmitteln. Natron dient als Back- und Feuerlöschpulver, zu Medikamenten und als Futterzusatz.
Weitere bedeutende Folgeprodukte sind Kunststoffe, medizinische Präparate und Schädlingsbekämpfungsmittel.
Auftausalz
Steinsalz wird im Winter bei mäßigen Frosttemperaturen als Streusalz (Auftausalz) verwendet, es werden teilweise Zusätze zur Erhaltung der Rieselfähigkeit zugegeben. In Deutschland wird Auftausalz eingefärbt, um dessen Verwendung in der Zubereitung von Lebensmitteln zu unterbinden. Daneben wird Sole eingesetzt, die auf Streufahrzeugen erst unmittelbar vor dem Streuen zur Erzeugung von besser geeignetem Feuchtsalz zudosiert wird.
Gewerbesalz
Als Gewerbesalz wird praktisch alles gewerblich, technisch oder industriell verwendete Salz bezeichnet, das nicht in eine der drei anderen Kategorien fällt. Salz zum Zweck der Nahrungsmittelkonservierung zählt, obwohl in geringer Menge verzehrt, zum Gewerbesalz. Das Spektrum des Gewerbesalzes ist daher sehr groß und reicht von grobem ungereinigten Steinsalz bis zu hochreinem Natriumchlorid und sterilen Zubereitungen für chemische, pharmazeutische und medizinische Zwecke. Je nach Verwendung sind außerdem unterschiedlichste Zusätze zugefügt.
Viehhaltung
Auch für Tiere ist Salz lebensnotwendig. So werden beispielsweise Nutztieren wie Rindern, Schafen und Ziegen dem Futter Viehsalz (ungereinigtes, vergälltes Steinsalz mit anderen Mineralsalzen) beigemengt. Dies steigert ihren Appetit und trägt zur allgemeinen Gesundheit bei.[8]
Bekannt sind auch Salzlecksteine, die in zoologischen Gärten, in der Viehwirtschaft, der Haus- und Heimtierhaltung sowie für Wildtiere verwendet werden.
Konservierung
Salz wird traditionell zur Konservierung von Lebensmitteln wie Fleisch (Pökeln, Suren), Fisch (etwa Salzhering), Gemüse (Sauerkraut) usw. verwendet. Dabei entzieht das hygroskopische Salz dem Gut die Feuchtigkeit. So wird die Grundlage Wasser für schädliche Organismen entzogen, aber auch Keime und Krankheitserreger abgetötet.
Nitritpökelsalz besteht aus einer Mischung aus Kochsalz und Natriumnitrat, Natriumnitrit oder Kaliumnitrat.
Das Einlegen von Gemüse (etwa Salzgurken, Oliven) in Salzlake nutzt den keimtötenden Effekt.
Käse wird vor der Reifung in Salzwasser vorbereitet und während der Reifung mit einer Salzlake gepflegt, damit die Kruste trocken bleibt.
Physikalisch/Chemische Anwendungen
Salz wird als Regeneriersalz zur Wasserenthärtung in Geschirrspülmaschinen und Wasseraufbereitungsanlagen verwendet. In Kältemischungen wird es mit Wasser versetzt.
Auch bei der Lederverarbeitung und in der Färberei ist Salz ein unverzichtbarer Rohstoff.
Bei der Herstellung von Geschirr und anderer Keramik wird durch das Verdampfen von feuchtem Salz unter hoher Temperatur die traditionelle Salzglasur erzeugt.
Die ionisierende Wirkung des Salzes wird in der Metallverarbeitung eingesetzt.
Medizin
In der modernen Medizin wird nach starkem Blutverlust, etwa bei einer Operation oder einem Unfall, eine 0,9%ige Lösung von Natriumchlorid in Wasser zur Auffüllung des Blutvolumens intravenös verabreicht (isotonische Kochsalzlösung, auch physiologische Kochsalzlösung). Sie ist isoosmotisch mit dem Blutplasma.
In der Antike und im Mittelalter galten Medikamente auf Salzbasis als reine Wundermittel. Die Haut Neugeborener wurde zu deren Stärkung mit Salz abgerieben. Es wurde in Wundverbänden, Pflastern, Salben, Pudern und Bädern eingesetzt. Besondere Bedeutung maß man der trocknenden und wärmenden Wirkung des Salzes bei.
Man streute Salz in Wunden, um Entzündungen zu verhindern – eine mitunter sehr schmerzhafte Prozedur, die in einer entsprechenden Redewendung („Salz in offene Wunden streuen“) Einzug in die deutsche Sprache gefunden hat.[9] Reines Salz zerstört über Osmose alle Zellen - also auch krankmachende Mikroorganismen wie Bakterien und Pilze, allerdings die Zellen des Verwundeten ebenso. Diese Art der Desinfektion ist also zweischneidig wie das ebenso praktizierte Ausbrennen von Wunden. Der gleiche Wirkmechanismus verhinderte, dass in Kochsalz konservierte Lebensmittel verdarben – also von Mikroorganismen zersetzt wurden.
Noch heute werden Solebäder als Heilmittel eingesetzt. Kuraufenthalte am Meer oder in salzhaltiger Luft bei Salinen und früher auch in Salzbergwerken dienen der Behandlung von Atemwegserkrankungen. Wo dies nicht möglich oder zu teuer ist, werden Inhalationsgeräte eingesetzt, bei denen Salz-Aerosol eingeatmet wird.
Kochsalz-Lösung wird auch zur Nasenspülung und zum Gurgeln verwendet. Für die Nasenspülung verwendet man isotonische Kochsalzlösung, da normales Wasser aufgrund der Osmose die Schleimhäute aufquellen lassen würde.
Infrarot-Optik
Einkristallines Natriumchlorid ist transparent im mittleren Infrarot, es ist daher als Material für Linsen, Prismen und Fenster in diesem Wellenlängenbereich geeignet. Nachteilig ist seine Affinität zu Wasser, daher ist es heute weitgehend durch andere Werkstoffe ersetzt worden.
Chemische Analytik
Natriumchlorid ist Urtitersubstanz nach Arzneibuch zur Einstellung von Silbernitrat-Maßlösungen. Um eine Maßlösung mit Natriumchlorid herzustellen muss es zuerst getrocknet werden.
Speisesalz
Hauptartikel: Speisesalz
Salze sind für den Menschen lebensnotwendig (siehe physiologische Bedeutung). Früher war Kochsalz daher recht kostbar. Die Zubereitung von Speisen wird vereinfacht und durch die Funktion als Gewürz im Geschmack verbessert. Die letale Dosis wird beim Erwachsenen mit 0,5 bis 5 Gramm je Kilogramm Körpergewicht angegeben, bei Kleinstkindern mit 12 mg/kg.[2] Speisesalz-Kristalle sind zur Erhaltung der Rieselfähigkeit meist mit einem Trennmittel umhüllt.
Heute ist das im Handel erhältliche Salz oft iodiert, also mit Iod versetzt (Iodsalz), und soll laut gängiger Meinung einem möglicherweise vorkommenden Iodmangel vorbeugen.
Auch sind Produkte mit Zusätzen von Natriumfluorid (zu Verbesserung der Zahngesundheit) und/oder Folsäure im Handel .
Siehe auch
- Halit: mineralogische Eigenschaften
- Speisesalz: physiologische Bedeutung, Verbrauch und Handel
- Salzbergwerk und Saline: Darstellung verschiedener Arten der Salzgewinnung und deren Geschichte
- Halurgie (griech.; auch Halotechnik, Salzwerkskunde) ist die historische Bezeichnung für die Lehre von der Gewinnung des Kochsalzes.
- Natriumchlorid-Struktur: Beschreibung der Kristallstruktur
Weblinks
Einzelnachweise
- ↑ M. Straumanis, A. Ievins: Die Gitterkonstanten des NaC1 und des Steinsalzes, Zeitschrift für Physik, 1936, 102, 353-359
- ↑ a b c d e Eintrag zu Natriumchlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15.10.2007 (JavaScript erforderlich)
- ↑ CRC Handbook of Chemistry and Physics, 88th edition, 2008
- ↑ Werner Gwosdz: Salz-Gemeinschaftsunternehmen esco. Hannover: Bundesanstalt für Geowissenschaften und Rohstoffe, 2002 (Commodity Top News 16)
- ↑ U.S. Geological Survey: Mineral Commodity Summaries, January 2008 : Salt – Im Internet unter http://minerals.usgs.gov/minerals/pubs/commodity/salt/
- ↑ British Geological Survey: World Mineral Production 2002–2006 – Im Internet unter http://www.bgs.ac.uk/mineralsuk
- ↑ U.S. Geological Survey: Mineral Commodity Summaries, January 2007 : Salt – Im Internet unter http://minerals.usgs.gov/minerals/pubs/commodity/salt/
- ↑ Jean-Francois Bergier, J. Grube: Die Geschichte vom Salz. Campus Verlag, 1989, ISBN 3593340895.
- ↑ Jean-Francois Bergier, J. Grube: Die Geschichte vom Salz. Campus Verlag, 1989, ISBN 3593340895, S. 144 ff..
Wikimedia Foundation.



