- Thujon
-
Strukturformel 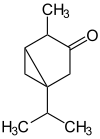
Struktur ohne Stereochemie Allgemeines Name Thujon Andere Namen - Absinthol
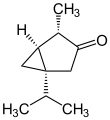
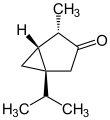
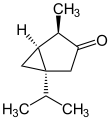
- 1-Isopropyl-4-methylbicyclo[3.1.0]hexan-3-on
- IUPAC: 4-Methyl-1-(propan-2-yl)bicyclo[3.1.0]hexan-3-on
- (–)-3-Isothujon
- 3-Thujanon
- α-Thujon
- L-Thujon
Summenformel C10H16O CAS-Nummer - 546-80-5 (α-Thujon)
- 471-15-8 (β-Thujon)
Kurzbeschreibung farblose Flüssigkeit[1]
Eigenschaften Molare Masse 152,24 g·mol−1 Aggregatzustand flüssig
Dichte 0,92 g·cm−3 (20 °C)[1]
Siedepunkt Dampfdruck Löslichkeit - sehr schlecht in Wasser[1]
- löslich in Ethanol[1], Diethylether[2] und Chloroform[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] (−)-α-Thujon

Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [3] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 500 mg·kg−1 (Ratte, oral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Unter Thujonen (Absinthol, Tanaceton) versteht man Stereoisomere des 1-Isopropyl-4-methylbicyclo[3.1.0]hexan-3-ons, es handelt sich also um bicyclische Monoterpen-Ketone, farblose Flüssigkeiten mit mentholartigem Geruch. Als Bestandteil ihrer ätherischen Öle sind Thujone unter anderem in Thuja, Thymian, Wermut, Rainfarn, Rosmarin, Beifuß und im Echten Salbei enthalten.
Inhaltsverzeichnis
Geschichte
Die Struktur konnte im Jahr 1900 von Friedrich Wilhelm Semmler aufgeklärt werden.
Vorkommen
In der Wermutpflanze (Artemisia absinthium) kommen α- und β-Thujone vor.[4] Bei der Herstellung von Absinth werden Thujone aus den Blättern des Wermutkrauts (Folia absinthii) oder der ganzen Pflanze (Herba absinthii) extrahiert. Thujone finden sich daneben auch in vielen anderen Artemisien und z. B. auch mit einem Anteil von bis zu 60 % in den ätherischen Ölen des Echten Salbeis (Salvia officinalis) und ebenfalls in der getrockneten Form des weißen Salbeis (Salvia apiana), welches u. a. zum Räuchern verwendet wird. Thujaöl enthält 40 (−)-α-Thujon, Rainfarnöl 58 % (+)-β-Thujon.[5]
Wirkungen
Thujone sind Nervengifte, die in höherer Dosierung Verwirrtheit und epileptische Krämpfe (Konvulsionen) hervorrufen können. Auch andere Symptome, wie z. B. Schwindel, Halluzinationen und Wahnvorstellungen, die nach Einnahme thujonhaltiger alkoholischer Getränke beobachtet werden konnten, wurden diesen Wirkstoffen zugeschrieben. Ebenso werden diese Getränke, insbesondere der Absinth, wegen einer angeblichen euphorisierenden und aphrodisierenden Wirkung beworben. Da der zulässige Thujongehalt in alkoholischen Getränken auf maximal 35 mg je kg begrenzt wurde, kann die Mehrzahl der Effekte des Absinthkonsums heutzutage jedoch eher dem Alkohol als den Thujonen zugeschrieben werden.[6] Die Symptome des chronischen Absinthkonsums (Absinthismus) sind identisch denen eines Alkoholismus.[7] Eine Studie[8] im Jahr 2008 wies in Proben aus der Zeit vor dem Verbot nur Konzentrationen von durchschnittlich 25 mg/l nach. Eine psychotrope Wirkung ist bei diesen Werten äußerst unwahrscheinlich.
Für die beschriebenen konvulsiven Wirkungen der Thujone werden insbesondere GABAA-Rezeptoren verantwortlich gemacht. Als Antagonisten und Modulatoren dieser Rezeptoren hemmen Thujone die antikonvulsive Wirkung der γ-Aminobuttersäure (GABA), wenngleich mit schwacher Potenz.[9] Auch eine Desensibilisierung von 5-HT3-Rezeptoren kann an den beobachteten Effekten beteiligt sein.[10] Ein möglicher gemeinsamer Wirkmechanismus mit dem Cannabis-Wirkstoff Tetrahydrocannabinol über eine Aktivierung von Cannabinoid-Rezeptoren, der auf Grund entfernter Analogien der Molekülstruktur und klinischen Wirkungen vermutet wurde,[11] konnte hingegen nicht bestätigt werden.[12] Für den bitteren Geschmack der Thujone wird eine Aktivierung des Geschmacksrezeptors TAS2R14 verantwortlich gemacht.[13]
Gesetzliche Vorschriften
Durch die Aromenverordnung[14] wird der Thujongehalt in Lebensmitteln begrenzt. In Getränken und anderen Lebensmitteln dürfen maximal 0,5 mg/kg enthalten sein. Lebensmittel, die Salbeizubereitungen enthalten, dürfen höchstens 25 mg/kg Thujone enthalten. Die Grenze in alkoholischen Getränken (Sonderregelung) hängt von dem Alkoholgehalt der Spirituose ab:
Branntweine:
- maximal 5 mg/kg bei einem Alkoholgehalt bis zu 25 % Vol.
- maximal 10 mg/kg bei einem Alkoholgehalt über 25 % Vol.
Bitter-Spirituosen:
- maximal 35 mg/kg bei einem Alkoholgehalt über 25 % Vol.
Einzelnachweise
- ↑ a b c d e f g Datenblatt α-Thujon bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ a b c Erowid
- ↑ a b Datenblatt (−)-α-Thujone bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Datenblatt α- und β-Thujon (Isomerengemisch) bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.12. Georg Thieme Verlag KG, Stuttgart 2011
- ↑ Olsen, R.W. (2000): Absinthe and γ-aminobutyric acid receptors. In: Proc. Natl. Acad. Sci. U.S.A. Bd. 97, S. 4417–4418.
- ↑ Padosch S.A., Lachenmeier D.W. & Kröner L.U. (2006): Absinthism: a fictitious 19th century syndrome with present impact. In: Subst. Abuse Treat. Prev. Policy. Bd. 1, S. 14.
- ↑ Lachenmeier D., Nathan-Maister D., Breaux T., Sohnius E.-M., Schoeberl K., Kuballa T. (2008): Chemical Composition of Vintage Preban Absinthe with Special Reference to Thujone, Fenchone, Pinocamphone, Methanol, Copper, and Antimony Concentrations J. Agric. Food Chem., 56 (9), S. 3073–3081.
- ↑ Hold K.M., Sirisoma N.S., Ikeda T., Narahashi T. & Casida J.E. (2000): α-thujone (the active component of absinthe): γ-aminobutyric acid type A receptor modulation and metabolic detoxification. Proc. Natl. Acad. Sci. U.S.A.. Bd. 97, S. 3826–3831.
- ↑ Deiml T., Haseneder R., Zieglgänsberger W., Rammes G., Eisensamer B., Rupprecht R. & Hapfelmeier G. (2004): α-Thujone reduces 5-HT3 receptor activity by an effect on the agonist-reduced desensitization. In: Neuropharmacology. Bd. 46, S. 192–201.
- ↑ del Castillo J., Anderson M. & Rubottom G.M. (1975): Marijuana, absinthe and the central nervous system. In: Nature. Bd. 253, S. 365–366.
- ↑ Meschler J.P. & Howlett A.C. (1999): Thujone exhibits low affinity for cannabinoid receptors but fails to evoke cannabimimetic responses. In: Pharmacol. Biochem. Behav. Bd. 62, S. 473–480.
- ↑ Behrens M., Brockhoff A., Kuhn C., Bufe B., Winnig M. & Meyerhof W. (2004): The human taste receptor hTAS2R14 responds to a variety of different bitter compounds. In: Biochem. Biophys. Res. Commun. Bd. 319, S. 479–485; PMID 15178431.
- ↑ Aromenverordnung (PDF, 33 kB)
Weblinks
Kategorien:- Gesundheitsschädlicher Stoff
- Psychotrope Substanz
- Nervengift
- Terpen
- Cyclopropan
- Cyclopentanon
- Sekundärer Pflanzenstoff
Wikimedia Foundation.