- Menthol
-
Strukturformel 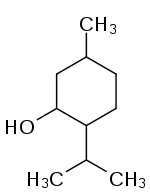
Allgemeines Name Menthol Andere Namen - 2-Isopropyl-5-methylcyclohexanol
- IUPAC: 5-Methyl-2-(propan-2-yl)-cyclohexan-1-ol
Summenformel C10H20O CAS-Nummer - 15356-60-2 [(+)-Menthol]
- 89-78-1 (DL-Menthol)
- 2216-51-5 [(–)-Menthol]
- 1490-04-6 (unspezifiziert)
Kurzbeschreibung farblose, glänzende Prismen[1]
Eigenschaften Molare Masse 156,27 g·mol−1 Aggregatzustand fest
Dichte 0,89 g·cm−3[2]
Schmelzpunkt (-)-Menthol: 31, 33, 35 und 42,5-43 °C (4 Modifikationen)[1]
Siedepunkt 216 °C[2]
Löslichkeit wenig löslich in Wasser, gut löslich in Ethanol, Diethylether und Chloroform[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 315-318-335 EUH: keine EUH-Sätze P: 261-280-305+351+338 [3] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36 S: 37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Menthol ist ein monocyclischer Monoterpen-Alkohol. Bei Raumtemperatur ist es ein farbloser, kristalliner Feststoff mit Pfefferminzgeruch. Die Symmetrie des Kristallgitters ist trigonal[4], die Kristalle sind nadelförmig. Menthol kommt in vielen ätherischen Ölen, besonders in Minzölen vor.
Inhaltsverzeichnis
Vorkommen
(+)-Neomenthol findet sich im japanischen Pfefferminzöl, (−)-Neoisomenthol mit bis zu einem Prozent im Geraniumöl.
Gewinnung und Darstellung
Die jährliche Weltproduktion liegt bei 6.300 Tonnen. Hauptsächlich wird Menthol immer noch durch Isolation aus Minzen, beispielsweise der Ackerminze oder Pfefferminze, gewonnen.
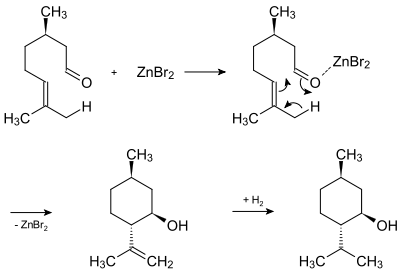
Das Bild zeigt die technische Synthese des (−)-Menthols. Sie geht vom Citronellal aus, dem Zinkbromid zugefügt wird. In einer Carbonyl-En-Reaktion wird es zum Isopulegol umgewandelt. Dieses wird an Nickelkatalysatoren zum Menthol hydriert. Dies ist aber nur eine von vielen Menthol-Synthesen: Menthol lässt sich auch ausgehend vom Pulegon, Phellandren, 3-Caren, Pinen, Limonen, Myrcen, Piperiton oder durch Hydrierung vom Thymol beziehungsweise dem Kresol synthetisieren.
1973 gelang dem Unternehmen Haarmann & Reimer erstmalig die vollsynthetische Herstellung von Menthol.
Eigenschaften und Isomerie
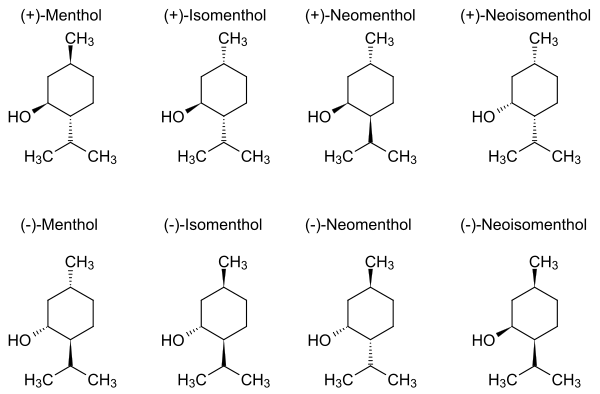
Menthol besitzt drei stereogene Zentren, deshalb gibt es acht Stereoisomere: (–)-Menthol, (+)-Menthol, (+)-Isomenthol, (–)-Isomenthol, (+)-Neomenthol, (–)-Neomenthol und (+)-Neoisomenthol sowie (–)-Neoisomenthol. Alle sind sekundäre, einwertige Alkohole: Das Molekül weist eine Hydroxygruppe auf; an das Kohlenstoffatom, an welches diese Hydroxygruppe gebunden ist, sind direkt nur zwei weitere Kohlenstoffatome gebunden.Die Geschmacksschwelle liegt zwischen 0,2 ppm für (+)-Menthol und 1 ppm für (–)-Menthol.
Die Gerüche der Stereoisomeren unterscheiden sich stark.
- (+)- und (–)-Menthol riechen vor allem kühl, frisch, minzig und süß, wobei diese Gerüche beim (–)-Menthol stärker ausgeprägt sind.
- Beim Isomenthol überwiegt im Geruch das (+)-Isomenthol, das schal, kühl, minzig, frisch und süß riecht, beide Enantiomere des Isomenthols riechen vor allem schal.
- Die beiden Neomenthole riechen ähnlich: schal, frisch, minzig und süß.
- Das (–)-Neoisomenthol riecht nach Campher, schal, süß, minzig, kühlend und frisch,
- das (+)-Neoisomenthol hat einen Geruch nach Campher, schal und nach Wald, es riecht hingegen nicht minzig, kühl und frisch.
Reaktionen
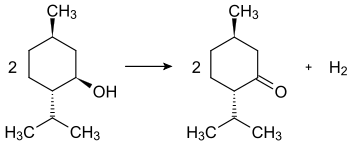
Durch Oxidation mit zum Beispiel Chromsäure geht Menthol [im Bild (–)-Menthol] in Menthon [im Bild (–)-Menthon] über.[5]
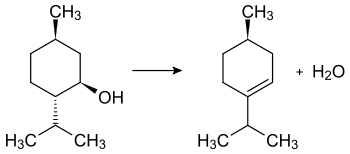
Durch Einwirkung von konzentrierter Schwefelsäure wird Menthol (im Bild (−)-Menthol) zu Menthen dehydratisiert
Verwendung
Menthol wird gelegentlich Zigaretten zur Aromatisierung zugesetzt. (–)-Menthol ist ein schwaches Lokalanästhetikum, daher wird angenommen, dass der Zusatz von Menthol zu Zigaretten die Inhalation der Tabakrauches erleichtert. Medizinische Anwendungen von (–)-Menthol: Es wird zum Beispiel als Analgetikum verwendet. Außerdem findet Menthol als Duft- und Aromastoff Verwendung sowie in der Bienenpflege gegen Milbenbefall.
Es wirkt am Kälte-Menthol-Rezeptor (TRPM8), daher hat Menthol einen (scheinbar) kühlenden Effekt beim Auftragen auf die Haut, die Körpertemperatur wird jedoch nicht beeinflusst. Diese Wirkung ist vergleichbar mit der von Capsaicin (scheinbar heißer Effekt).
Gefahrenhinweise
Menthol ist reizend; schon wenige Gramm Menthol verursachen Herzrhythmusstörungen. Zusätzliche Gefahr besteht für Säuglinge und Kleinkinder, da bei ihnen durch Inhalation von Menthol eine schwere Atemnot mit Atemstillstand auftreten kann. Die orale letale Dosis für eine Ratte liegt bei 3300 mg/kg. Der Metabolismus des Menthols läuft hauptsächlich in der Leber ab, es entsteht Mentholglucuronid. Außerdem schädigt es die Stimmbänder, weil es eine extreme Austrocknung des Kehlkopfes und der Stimmbänder verursacht.
Einzelnachweise
- ↑ a b c Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ a b c Eintrag zu Menthol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26.4.2008 (JavaScript erforderlich).
- ↑ a b Datenblatt (±)-Menthol bei Sigma-Aldrich, abgerufen am 9. April 2011.
- ↑ R.Bombicz, J.Bushmann, P.Luger, Nguyen Xuan Dung, Chu Ba Nam, Z. Kristallogr. 1999, 214, 420.
- ↑ H. C. Brown, C. P. Garg, J. Am. Chem. Soc. 1961, 83, 2952 – 2953.
Literatur
- Friedrich Hartmut Dost: Menthol and menthol-containing external remedies. Thieme-Verlag, Stuttgart (1967), ASIN B0000BSM92.
- Anja Langeneckert: Untersuchungen zur Pharmakokinetik und relativen Bioverfügbarkeit von α-Pinen, 1,8-Cineol und Menthol nach dermaler, inhalativer und peroraler Applikation ätherischer Öle. Shaker Verlag GmbH (1999), ISBN 3-8265-6457-X.
Weblinks
Wikimedia Foundation.