- Trichlormethansulfenylchlorid
-
Strukturformel 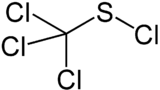
Allgemeines Name Trichlormethansulfenylchlorid Andere Namen - Trichlormethylsulfenylchlorid
- Trichlormethylschwefelchlorid
- Trichlormethansulfensäurechlorid
- Perchlormethylmercaptan
- Thiocarbonyltetrachlorid
- Trichlormethylsulfochlorid
- Chloroformthiohypochlorit
Summenformel CCl4S CAS-Nummer 594-42-3 Kurzbeschreibung gelbliche, übelriechende Flüssigkeit[1]
Eigenschaften Molare Masse 185,89 g·mol−1 Aggregatzustand flüssig
Dichte 1,69 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 147–149 °C[1]
Dampfdruck Löslichkeit unlöslich in Wasser[1]
Brechungsindex 1,5395[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 301-311-314-330 EUH: keine EUH-Sätze P: 260-280-284-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung [1] 
Sehr giftig (T+) R- und S-Sätze R: 21-25-26-34 S: 25-28-36/37/39-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Trichlormethansulfenylchlorid ist eine stark giftige chemische Verbindung mit der Summenformel CCl4S.
Inhaltsverzeichnis
Darstellung
Die Verbindung kann aus der Reaktion von Kohlenstoffdisulfid mit molekularem Chlor in Gegenwart von Iod hergestellt werden.[9]
Eine weitere Synthesemöglichkeit besteht in der Chlorierung von Dimethylsulfid.[10]
Eigenschaften
Trichlormethansulfenylchlorid ist eine übelriechende, toxische Flüssigkeit, die bei 147–149 °C siedet. In Benzol besitzt sie ein Dipolmoment von 0,65 D.[11]
Verwendung
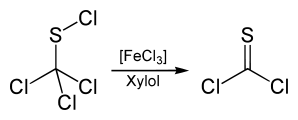
Die Substanz kann zur Synthese von Thiophosgen benutzt werden. Hierzu wird es mit Eisen(III)-chlorid-Katalysator bei 140 °C in Xylol umgesetzt.[12]
Trichlormethansulfenylchlorid wurde unter dem Decknamen „Clairsite“ von französischen und russischen Streitkräften im Ersten Weltkrieg als chemischer Kampfstoff eingesetzt.[13]
Sicherheitshinweise
Trichlormethansulfenylchlorid kann sowohl über die Atemwege, als auch dermal oder oral aufgenommen werden. Dabei reizt es Augen, Rachen, Bronchien und Alveolen. Im menschlichen Organismus erzeugt es Leber- und Nierenschäden.[14] Beim Tierversuch mit Ratten[7][8] und Mäusen[4][6] zeigte sich inhalativ und oral eine hohe Toxizität mit Symptomen wie Durchfall, Hautreizungen und -veränderungen sowie Atemnot.[5]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 594-42-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2008 (JavaScript erforderlich).
- ↑ I. B. Douglass, F. T. Martin, R. Addor: Sulfenyl Chloride studies. II. Mono-, Di-, and Tri-Chloromethanesulfenyl Chlorides and Certain of their Derivatives, in: J. Org. Chem., 1951, 16, S. 1297–1302.
- ↑ a b Datenblatt Trichloromethanesulfenyl chloride bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ a b Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure, Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, S. 97, 1982.
- ↑ a b c d e Trichlormethansulfenylchlorid bei ChemIDplus.
- ↑ a b National Technical Information Service. Vol. OTS0533569.
- ↑ a b Toxicology and Applied Pharmacology. Vol. 42, S. 417, 1977.
- ↑ a b Sbornik Vysledku Toxixologickeho Vysetreni Latek A Pripravku, Marhold, J.V., Institut Pro Vychovu Vedoucicn Pracovniku Chemickeho Prumyclu Praha, Czechoslovakia, S. 13, 1972.
- ↑ W. Autenrieth, H. Hefner: Über Versuche mit Thiophosgen, in: Chem. Ber., 1925, 58, S. 2151–2156.
- ↑ Patent Schering DE 416603.
- ↑ M. T. Rogers and K. J. Gross: The Electric Moments of Some Sulfur and Selenium Compounds, in: J. Am. Chem. Soc., 1952, 74, S. 5294–5296.
- ↑ E. F. Orwoll, US Patent 2668853.
- ↑ A. T. Schäfer: Lexikon biologischer und chemischer Kampfstoffe. Köster, Berlin, 2003. (ISBN 3-89574-515-4).
- ↑ Jürgen Fritze: Die ärztliche Begutachtung: Rechtsfragen, Funktionsprüfungen, Beurteilungen. 7. Auflage, Springer, 2008, ISBN 978-3-7985-1563-5, S. 296.
Wikimedia Foundation.