- Trinatriumhexafluoraluminat
-
Kryolith Kryolith mit Siderit, Galenit und Chalkopyrit aus Jvigtut, Grönland Chemische Formel Na3[AlF6] Mineralklasse Halogenide
3.CB.15 (8. Aufl.: III/B.03-30) (nach Strunz)Kristallsystem monoklin Kristallklasse monoklin-prismatisch 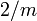
Farbe weiß, braun, grau, braun-schwarz, rötlich Strichfarbe weiß Mohshärte 2,5 Dichte (g/cm³) 2,96 bis 2,98 [1] Glanz feuchter Glasglanz, Fettglanz, Perlmuttglanz Transparenz durchsichtig bis durchscheinend Bruch uneben Spaltbarkeit keine Habitus pseudokubische Kristalle, massige Aggregate Häufige Kristallflächen Zwillingsbildung nach {110} Kristalloptik Brechzahl α=1,339 bis 1,339 ; β=1,339 bis 1,339 ; γ=1,340 bis 1,340 [1] Doppelbrechung
(optische Orientierung)δ = 0,001 [1] ; zweiachsig positiv Winkel/Dispersion
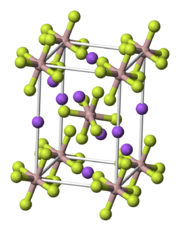
der optischen Achsen2vz ~ 43° Pleochroismus keiner Weitere Eigenschaften Schmelzpunkt 1000 °C Ähnliche Minerale Anhydrit, Fluorit, Halit Kryolith (Aluminiumtrinatriumhexafluorid, Natriumhexafluoroaluminat(III)) ist ein eher selten vorkommendes Mineral aus der Mineralklasse der Halogenide. Es kristallisiert im monoklinen Kristallsystem mit der chemischen Zusammensetzung Na3[AlF6] [2] und entwickelt entweder pseudokubische Kristalle oder massige Aggregate in weißer, brauner, grauer, braun-schwarzer oder rötlicher Farbe.
Inhaltsverzeichnis
Besondere Eigenschaften
Bei einer Temperatur von etwa 560 °C wechselt Kryolith in das kubische Kristallsystem über. Aufgrund dieser Eigenschaft ist das Mineral ein wichtiges geologisches Thermometer zur Klärung der Bildungsbedingungen von Gesteinen. Beim Glühen in einer offenen Glasröhre wird Fluorwasserstoff freigesetzt.
Kryolith ist in konzentrierter Schwefelsäure vollständig lösbar, in Salzsäure dagegen nur teilweise.
Etymologie und Geschichte
Erstmals gefunden und beschrieben wurde Kryolith 1799 in Ivigtut in Grönland von Peder Christian Abildgaard (1740-1801). Er benannte das Mineral aufgrund seines charakteristischen Aussehens nach den griechischen Worten κρύος [krúos] „Frost, Eis“ (im deutschen Wort „(Eis)kruste“ über das lateinische „crusta“ und althochdeutsche „hroso“ für „Kruste, Eis“ noch zu finden; verwandt mit Tocharisch A „krost“ für „kalt“) und λίθος [lítʰos] „Stein“ (Etymologie unklar), zusammengesetzt also „Eis-Stein“.
Klassifikation
Nach der alten Systematik der Minerale nach Strunz (8. Auflage) gehört der Kryolith zu den wasserfreien Doppelhalogeniden. Diese Mineralklasse ist jedoch seit der 9. Auflage der Strunz'schen Mineralsystematik neu strukturiert und die Klassifizierung der komplexen Halogenide orientiert sich jetzt mehr an der Kristallstruktur. Kryolith findet sich demnach in der Unterabteilung „Insel-Aluminofluoride (Neso-Aluminofluoride)“.
Bildung und Fundorte
Kryolith bildet sich als Evaporit vor allem in zinnführenden Granit-Pegmatiten und in fluoritreichen, topashaltigen Rhyolithen.
Der wichtigste abbauwürdige Fundort Ivigtut (Kitaa) in Grönland ist inzwischen erschöpft. Abgebaut wurde Kryolith dort zwischen 1865 und 1987. Daneben wurde das Mineral noch an folgenden Orten entdeckt:
- In nördlichen und südlichen Regionen von Brasilien;
- Sachsen in Deutschland;
- Québec in Kanada;
- bei Semei in Kasachstan;
- Khomas und Kunene in Namibia;
- Bauchiplateau in Nigeria;
- Oppland in Norwegen;
- die Regionen Ostsibirien, Nordwestrussland und Ural in Russland;
- Aragonien in Spanien;
- Böhmen in Tschechien;
- Oblast Schytomyr in der Ukraine; sowie
- mehrere Regionen in den USA. [3]
Synthetische Herstellung
Die Synthese erfolgt aus Hexafluorokieselsäure und Natriumaluminat.
Struktur
Kryolith kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a mit den Gitterparametern a = 5,4024 Å; b = 5,5959 Å, c = 7,7564 Å und β = 90,278 ° sowie zwei Formeleinheiten pro Elementarzelle. [4]
Verwendung
Eine großtechnische Anwendung von Kryolith ist die Schmelzflusselektrolyse zur Gewinnung von Aluminium. Dort wird die Eigenschaft des relativ niedrigen Schmelzpunktes von Kryolith (1000 °C) genutzt. Aluminiumoxid (Korund), der Ausgangsstoff der Elektrolyse, hat eine Schmelztemperatur von 2050 °C. Für die Schmelzflusselektrolyse wird die eutektische Mischung verwendet. Sie besteht aus 10,5 % Al2O3 und Na3[AlF6]. Der Schmelzpunkt des Eutektikums liegt dann bei 960 °C. Erst diese relativ niedrige Arbeitstemperatur ermöglicht die großtechnische Anwendung der Schmelzflusselektrolyse.
Kryolith wird weiter in der Gießereiindustrie eingesetzt. Dem Formstoff beim Gießen kann Kryolith beigemischt werden. Dieses Beimischen kann jedoch die Oberflächenqualität des Werkstücks negativ beeinflussen.
Synthetisch hergestelltes Kryolith findet in der Hülle von Schweißelektroden als Flussmittel Verwendung.
Kryolith wird außerdem als schleifaktive Substanz in kunstharzgebundenen Schleifmitteln sowie in Schleifmitteln auf Unterlagen genutzt. Aufgrund der hohen Temperaturen, die beim Schleifen an der Spitze des Schleifkorns auftreten, schmilzt das Kryolith. Dabei korrodiert das geschmolzene Kryolith den abgeschliffenen Stahlspan und verhindert damit ein Zusetzen des Schleifkörpers.
Problematisch ist das Auftreten von Kryolith bei der Zinkphosphatierung von zum Beispiel Aluminium-Automobilkarossen oder feuerverzinkten Oberflächen. Aluminium wird hierbei im Phosphatierbad als Kryolith ausgefällt und muss wieder herausgefiltert werden.
Kryolith wird auch zur Herstellung optisch hochreflektiver Oberflächen verwendet. Es wird dabei in dünnen Schichten abwechselnd mit einem anderen Stoff, zum Beispiel Zinkselenid, im Vakuum aufgedampft (Vielschichtspiegel in der Lasertechnik).
Vorsichtsmaßnahmen
Das Mineral bzw. die chemische Verbindung wird als giftig und umweltgefährlich eingestuft. [5] Gesundheitsschädlich ist vor allem das Einatmen und Verschlucken von Kryolithteilchen, die akut zu Beschwerden im Atemstrakt mit funktioneller Dyspnoe (erschwerte Atemtätigkeit) und schließlich Lungenemphysem (Überblähung der Lungenbläschen) führen können. Des Weiteren sind Appetitlosigkeit, Übelkeit, Erbrechen und Verstopfung die Folge.
Längerfristig hat Kryolith eine toxische Wirkung auf Knochen, Zähne und Nieren.
Siehe auch
- Kryolithglas
- Peter Hoeg: „Fräulein Smillas Gespür für Schnee“
Einzelnachweise
- ↑ a b c MinDat - Cryolite (engl.)
- ↑ Stefan Weiß: Das große Lapis Mineralienverzeichnis. 5. Auflage. Christian Weise Verlag, München 2008, ISBN ISBN 3-921656-17-6.
- ↑ MinDat - Localities for Cryolite (engl.)
- ↑ American Mineralogist Crystal Structure Database - Cryolite (engl.)
- ↑ GDL Gefahrstoffdatenbank der Länder - Aluminiumtrinatriumhexafluorid (=Kryolith)
Literatur
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel Verlag GmbH, Eggolsheim 2002, ISBN 3-89555-076-0, S. 67.
- Paul Ramdohr, Hugo Strunz: Klockmanns Lehrbuch der Mineralogie. 16. Auflage. Ferdinand Enke Verlag, 1978, ISBN 3-432-82986-8, S. 490,491.
- Riedel, E. (2002). Anorganische Chemie. de Gruyter, Berlin.
- Holleman-Wiberg (1995). Lehrbuch der Anorganischen Chemie. de Gruyter, Berlin.
Weblinks
- Mineralienatlas:Kryolith (Wiki)
- Mineraldatenblatt - Cryolite (engl., PDF 96,6 KB)
- Sicherheitsdatenblatt zu Kryolith (PDF 19 KB)
Wikimedia Foundation.



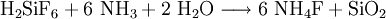
![\mathrm{6 \ NH_4F + 3 \ NaOH + Al(OH)_3 \longrightarrow Na_3[AlF_6] + 6 \ NH_3 + 6 \ H_2O}](/pictures/dewiki/101/e45fd54632edec73132e616cb55c63fe.png)