- Biopterin
-
Strukturformel 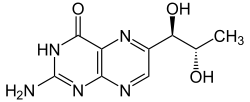
Allgemeines Name Biopterin Andere Namen - 2-Amino-6-(L-erythro- 1,2-dihydroxypropyl)- 3H-pteridin-4-on
- (S-(R*,S*))-2-Amino- 6-(1,2-dihydroxypropyl)- 1H-pteridin-4-on
Summenformel C9H11N5O3 CAS-Nummer 22150-76-1 PubChem 444475 Kurzbeschreibung gelbe Kristalle[1]
Eigenschaften Molare Masse 237,22 g·mol−1 Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Biopterin ist eine heterocyclische Verbindung, die als Redox-Cofaktor im Stoffwechsel bedeutsam ist. Das wesentliche Strukturmerkmal ist ein heterocyclisches Pteridin-Ringsystem, damit ist es ein Derivat des Pterins.
Biopterin wird durch Oxidation von Tetrahydrobiopterin mit GTP gebildet.[3]
Biologische Bedeutung
Biopterin – genauer das sich daraus ableitende Redoxpaar 7,8-Dihydrobiopterin/5,6,7,8-Tetrahydrobiopterin (letzteres auch BH4 abgekürzt) – spielt als Cofaktor eine wichtige Rolle im Stoffwechsel. Im Gegensatz zu den Pteridin-Abkömmlingen Folsäure und Riboflavin kann es jedoch vom menschlichen Körper selbst synthetisiert werden und ist somit nicht essentiell. Nur die Tetrahydroform des Biopterins ist biologisch aktiv.
Besondere Bedeutung kommt dem Biopteridin-Redoxsystem bei der Oxidation aromatischer Ringe zu. Eine solche Oxidation findet z. B. bei der Biosynthese der Aminosäure Tyrosin aus Phenylalanin durch die Phenylalaninhydroxylase, bei der Synthese von Catecholaminen im Schritt der Oxidation des Tyrosins zur L-DOPA durch die Tyrosinhydroxylase oder bei der Serotonin-Biosynthese im Schritt der Oxidation des Tryptophans zum 5-Hydroxytryptophan durch die Tryptophanhydroxylase statt. Eine Besonderheit dieser Oxidationen ist, dass sie die Gegenwart molekularen Sauerstoffs erfordern (siehe auch Abbildung zuunterst).
Störungen im Biopterin-Stoffwechsel führen aufgrund der Bedeutung für den Metabolismus aromatischer Aminosäuren u. a. zu sogenannten „atypischen“ Phenylketonurien.
Die Stickstoffmonoxid-Synthase (NOS), die über mehrere Stufen Arginin zu Stickstoffmonoxid (NO) und Citrullin oxidiert, ist ebenfalls tetrahydrobiopterinabhängig.
Das Redoxsystem Dihydrobiopterin/Tetrahydrobiopterin ist vergleichsweise komplex – man betrachte dazu beispielsweise die Redoxsysteme der Cofaktoren NAD oder FAD. Für die Regeneration der oxidierten aus der reduzierten Form sorgt ein eigenes Enzymsystem: die Pterin-4a-carbinolamin-Dehydratase (EC 4.2.1.96) und die Dihydropteridin-Reduktase (EC 1.5.1.34). Die folgende Abbildung versinnbildlicht den zugehörigen Zyklus:
 Schema des Redoxsystems 5,6,7,8-Tetrahydrobiopterin (1), 4a-Hydroxytetrahydrobiopterin (2) und 6,7-Dihydrobiopterin (3). Eine Tetrahydrobiopterin-abhängige Monooxygenase (A) hydroxyliert einen Aromaten, wodurch 4a-Hydroxytetrahydrobiopterin entsteht. Dieses wird zu 6,7-Dihydrobiopterin unter Abspaltung von Wasser umgesetzt, was eine 4a-Hydroxytetrahydrobiopterin-Dehydratase (B) katalysiert. Die 6,7-Dihydropteridin-Reduktase (C) schließlich ermöglicht die NAD(P)H-abhängige Umwandlung von 5,6,7,8-Tetrahydrobiopterin und 6,7-Dihydrobiopterin.
Schema des Redoxsystems 5,6,7,8-Tetrahydrobiopterin (1), 4a-Hydroxytetrahydrobiopterin (2) und 6,7-Dihydrobiopterin (3). Eine Tetrahydrobiopterin-abhängige Monooxygenase (A) hydroxyliert einen Aromaten, wodurch 4a-Hydroxytetrahydrobiopterin entsteht. Dieses wird zu 6,7-Dihydrobiopterin unter Abspaltung von Wasser umgesetzt, was eine 4a-Hydroxytetrahydrobiopterin-Dehydratase (B) katalysiert. Die 6,7-Dihydropteridin-Reduktase (C) schließlich ermöglicht die NAD(P)H-abhängige Umwandlung von 5,6,7,8-Tetrahydrobiopterin und 6,7-Dihydrobiopterin.
Einzelnachweise
- ↑ a b Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ a b c Datenblatt Biopterin bei Sigma-Aldrich, abgerufen am 13. März 2011.
- ↑ Pteridine, in: Römpp Lexikon Chemie, Online-Version, 2009.
Weblinks
 Wikibooks: Biosynthese von Biopterin ausgehend von GTP – Lern- und Lehrmaterialien
Wikibooks: Biosynthese von Biopterin ausgehend von GTP – Lern- und Lehrmaterialien
Wikimedia Foundation.
