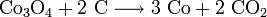- Cobalt-60
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Cobalt, Co, 27 Serie Übergangsmetalle Gruppe, Periode, Block 9, 4, d Aussehen metallisch mit einem
bläulich-gräulichen FarbtonCAS-Nummer 7440-48-4 Massenanteil an der Erdhülle 0,003 % Atomar Atommasse 58,93320 u Atomradius (berechnet) 135 (152) pm Kovalenter Radius 126 pm Elektronenkonfiguration [Ar]3d74s2 Elektronen pro Energieniveau 2, 8, 15, 2 Austrittsarbeit 5,0 eV 1. Ionisierungsenergie 760,4 kJ/mol 2. Ionisierungsenergie 1648 kJ/mol 3. Ionisierungsenergie 3232 kJ/mol 4. Ionisierungsenergie 4950 kJ/mol Physikalisch Aggregatzustand fest Modifikationen 2 (α/β-Cobalt) Kristallstruktur hexagonal beziehungsweise kubisch
(Übergangstemp. hcp→fcc: ~421 °C)Dichte 8,9 g/cm3 Mohshärte 5,0 Magnetismus ferromagnetisch Schmelzpunkt 1768 K (1495 °C) Siedepunkt 3200 K (2927 °C) Molares Volumen 6,67 · 10−6 m3/mol Verdampfungswärme 376,5 kJ/mol Schmelzwärme 16,19 kJ/mol Dampfdruck 175 Pa bei 1768 K Schallgeschwindigkeit 4720 m/s bei 293,15 K Spezifische Wärmekapazität 420 J/(kg · K) Elektrische Leitfähigkeit 17,2 · 106 A/(V · m) Wärmeleitfähigkeit 100 W/(m · K) Chemisch Oxidationszustände 2, 3 Oxide (Basizität) amphoter (neutral) Normalpotential −0,277 V (Co2+ + 2e− → Co) Elektronegativität 1,88 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 55Co 17,53 h ε 3,451 55Fe 56Co 77,27 d ε 4,566 56Fe 57Co 271,79 d ε 0,836 57Fe 58Co 70,86 d ε 2,307 58Fe 59Co 100 %
Stabil 60Co 5,2714 a β-,γ,γ 0,31+1,17+1,33 60Ni 61Co 1,850 h β- 1,322 61Ni NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 42/43-53 S: (2)-22-24-37-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Cobalt (chemische Fachsprache; standardsprachlich Kobalt; von lateinisch cobaltum Kobold) ist ein chemisches Element mit dem Symbol Co und der Ordnungszahl 27. Cobalt ist ein ferromagnetisches Schwermetall aus der 9. Gruppe (früher 8. Nebengruppe) des Periodensystems der Elemente. Es zählt zu den Übergangsmetallen. 1735 entdeckte der schwedische Chemiker Georg Brandt das bis dahin unbekannte Element und gab ihm den heutigen Namen.
Eine Besonderheit stellt die molare Masse von Cobalt dar, sie ist mit 58,93 größer als die von Nickel mit 58,69, dem nächsten Element im Periodensystem. Diese Besonderheit gibt es auch zwischen Argon (39,95) und Kalium (39,10) sowie zwischen Tellur (127,60) und Iod (126,90).
Inhaltsverzeichnis
Geschichte
Cobaltverbindungen sind schon seit sehr langer Zeit bekannt und wurden vorwiegend zum Färben von Glas und Keramik verwendet (Cobaltblau).
Cobalterze sind schon seit langer Zeit bekannt. Im Mittelalter wurden sie häufig für wertvolle Silber- und Kupfererze gehalten. Da sie sich aber nicht verarbeiten ließen und wegen des Arsengehalts beim Erhitzen schlechte Gerüche abgaben, wurden sie als verhext angesehen. Angeblich hätten Kobolde das kostbare Silber aufgefressen und an seiner Stelle wertlosere silberfarbene Erze ausgeschieden. Neben Cobalt waren dies auch Wolfram- und Nickelerze. Diese Erze wurden von den Bergleuten dann mit Spottnamen wie Nickel, Wolfram (etwa „Wolfsspucke“, lat. lupi spuma) und eben Kobolderz, also Cobalt belegt.[2]
Erstmals dargestellt wurde Cobalt 1735 vom schwedischen Chemiker Georg Brandt.
Vorkommen
Cobalt ist ein seltenes Element mit einer Häufigkeit in der Erdkruste von ca. 0,003 %.[3] Damit steht es in der Liste der nach Häufigkeit geordneten Elemente an 30. Stelle.[4] Elementar kommt es nur äußerst selten in Meteoriten sowie im Erdkern vor. In vielen Mineralen ist Cobalt vertreten, kommt jedoch meist nur in geringen Mengen vor. Das Element ist stets mit Nickel, häufig auch mit Kupfer, Silber, Eisen oder Uran vergesellschaftet. Nickel ist dabei etwa drei- bis viermal so häufig wie Cobalt. Beide Elemente sind chalkophil (schwefelliebend) und für basische und ultrabasische Magmatite charakteristisch.
Es gibt eine Reihe Cobalterze, in denen sich das Cobalt durch Verwitterung oder andere Prozesse angereichert hat. Die wichtigsten sind: Cobaltit (veraltet Kobaltglanz; CoAsS), Linneit und Siegenit (veraltet und irreführend Kobaltnickelkies [5]), (Co,Ni)3S4), Erythrin (veraltet Kobaltblüte), Asbolan (veraltet Erdkobalt), Skutterudit (Speiskobalt, Smaltin, CoAs3) und Heterogenit (CoOOH).
Der Cobaltgehalt der sulfidischen Erze ist aber gering (meist nur 0,1–0,3 %[3]). Wichtige Erzlagerstätten befinden sich in Kanada, Sambia, Marokko, Demokratische Republik Kongo, Kuba, Russland, Australien und in den USA.
Cobalt findet sich als Spurenelement in den meisten Böden.
Die Staaten mit der größten Förderung
Die Staaten mit der größten Förderung von Cobalt (2006)[6] Rang Land Fördermengen
(in Tonnen pro Jahr)Fördermengen
(in Prozent)1 Demokratische Republik Kongo 22000 38,3 2 Sambia 8600 15,0 3 Australien 6000 10,4 4 Kanada 5600 9,7 5 Russische Föd. 5100 8,9 6 Kuba 4000 7,0 7 Marokko 1500 2,6 8 China 1400 2,4 9 Neukaledonien 1100 1,9 10 Brasilien 1000 1,7 10 Andere Länder 1200 2,1 10 Gesamt 57500 100,0 Gewinnung und Darstellung
Cobalt wird überwiegend aus Kupfer- und Nickelerzen gewonnen. Die genaue Gewinnungsart ist von der Zusammensetzung des Ausgangserzes abhängig. Zunächst wird ein Teil des vorhandenen Eisensulfids durch Rösten in Eisenoxid umgewandelt und mit Siliciumdioxid als Eisensilicat verschlackt. Es entsteht der sogenannte Rohstein, der neben Cobalt noch Nickel, Kupfer und weiteres Eisen als Sulfid oder Arsenid enthält. Durch weiteres Abrösten mit Natriumcarbonat und Natriumnitrat wird weiterer Schwefel entfernt. Dabei bildet sich aus einem Teil des Schwefels und Arsens Sulfate und Arsenate, die mit Wasser ausgelaugt werden. Es bleiben die entsprechenden Metalloxide zurück, die mit Schwefel- oder Salzsäure behandelt werden. Dabei löst sich nur Kupfer nicht, während Nickel, Cobalt und Eisen in Lösung gehen. Mit Chlorkalk kann anschließend selektiv Cobalt als Cobalthydroxid ausgefällt und damit abgetrennt werden. Durch Erhitzen wird dieses in Cobalt(II,III)-oxid (Co3O4) umgewandelt und anschließend mit Koks oder Aluminiumpulver zu Cobalt reduziert:
Eigenschaften
Physikalische Eigenschaften
Cobalt ist ein stahlgraues, sehr zähes Schwermetall mit einer Dichte von 8,9 g/cm3.[7] Es ist ferromagnetisch mit einer Curie-Temperatur von 1150 °C[7]. Cobalt tritt in zwei Modifikationen, α-Cobalt mit einem hexagonal-dichtesten und β-Cobalt in einer kubisch-flächenzentrierten Kugelpackung, auf. Als typisches Metall leitet es Wärme und Strom (elektrische Leitfähigkeit 26 % von der des Kupfers[3]).
Chemische Eigenschaften
Im chemischen Verhalten ist es dem Eisen und Nickel ähnlich, an der Luft durch Passivierung beständig; es wird nur von oxidierend wirkenden Säuren gelöst. Cobalt zählt mit einem Normalpotential von −0,277 V zu den unedlen Elementen. In Verbindungen kommt es vorwiegend in den Oxidationsstufen +II und +III vor. Es sind jedoch folgende Oxidationsstufen –I, 0, +I, +II, +III, +IV und +V in Verbindungen vertreten. Cobalt bildet eine Vielzahl von – meist farbigen – Komplexen. Darin ist – im Gegensatz zu kovalenten Verbindungen – die Oxidationsstufe +III häufiger und stabiler als +II.
Isotope
Es sind insgesamt 28 Isotope und 10 weitere Kernisomere zwischen 47Co und 75Co bekannt. Natürliches Cobalt besteht dabei zu 100 % aus dem Isotop 59Co. Das Element ist daher eines der 22 Reinelemente.[8] Dieses Isotop lässt sich durch die NMR-Spektroskopie untersuchen.
Das Nuklid 57Co zerfällt über Elektroneneinfang zu 57Fe. Die beim Übergang in den Grundzustand des Tochterkerns emittierte Gammastrahlung hat eine Energie von nur 14,4 keV. Hauptanwendung von 57Co ist die Mößbauerspektroskopie zur Unterscheidung von zweiwertigem und dreiwertigem Eisen.
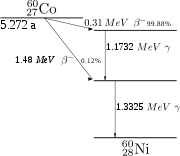
Das langlebigste der instabilen Isotope ist 60Co (Cobalt-60, Spin 5+), das mit einer Halbwertszeit von 5,26 Jahren unter Betazerfall zunächst in einen angeregten Zustand von 60Ni (Spin 4+) und anschließend unter Aussendung von Gammastrahlung (zwei Gammaquanten der Energie 1,17 und 1,33 MeV[9]) in den Grundzustand (Spin 0+) dieses Nuklids zerfällt. Aus diesem Grund wird 60Co als Gammastrahlungsquelle zur Sterilisierung oder Konservierung von Lebensmitteln, zur Materialuntersuchung (Durchstrahlungsprüfung) und in der Krebstherapie („Kobaltkanone“) verwendet.[10] In der Medizin können auch andere Isotope wie 57Co oder 58Co als Tracer verwendet werden.[11]
Aufgrund der relativ kurzen Halbwertszeit gibt es keine natürlichen Vorkommen von 60Co. Die Gewinnung erfolgt durch Neutronenaktivierung aus 59Co. Als Neutronenquelle für die Herstellung kleinerer Mengen dienen Spontanspaltungsquellen wie 252Cf, zur Herstellung größerer Mengen werden 59Co-Pellets dem Neutronenfluss in Kernreaktoren ausgesetzt.
Die Entstehung von 60Co aus 59Co unter Neutronenstrahlung könnte potentiell auch zur Verstärkung der Wirkung von Kernwaffen benutzt werden, bei denen Neutronenstrahlung entsteht, indem diese mit Cobalt ummantelt würden (Cobaltbombe). Bei der Detonation würde dann der starke Gammastrahler gebildet, durch den die Umgebung stärker kontaminiert würde als durch die Kernexplosion allein.[12] Wird 60Co nicht sachgerecht entsorgt, sondern mit anderem Cobalt eingeschmolzen und zu Stahl verarbeitet, kann es passieren, dass daraus gefertigte Stahlteile radioaktiv sind.[13]
Mit 60Co wurde das Wu-Experiment durchgeführt, mit dem die Paritätsverletzung der schwachen Wechselwirkung entdeckt wurde.[14]
Anwendungen
Als Legierungsbestandteil zur Erhöhung der Verschleiß- und Warmfestigkeit von legierten und hochlegierten Stählen und Superlegierungen, als Binderphase in Hartmetall-Sinterwerkstoffen und Diamantwerkzeugen, als Oxid, Sulfat, Hydroxid oder Carbonat in hitzefesten Farben und Pigmenten (z. B. für die Bemalung von Porzellan und Keramik), als Bestandteil von magnetischen Legierungen, als Acetat in Trocknern für Farben und Lacke, als Katalysator (Entschwefelung/Hydrierung), als Hydroxid oder Lithium-Cobalt-Oxid (LiCoO2) in Batterien, in korrosions- bzw. verschleißfesten Legierungen und als Spurenelement für Medizin und Landwirtschaft. Seine Verwendung als Legierungselement und in Cobaltverbindungen macht es zu einem strategisch wichtigen Metall. (Siehe Vitallium: Implantate, Turbinenschaufel, Chemische Apparate).
Physiologie
Cobalt ist für die menschliche Ernährung ein essentielles Spurenelement als Bestandteil von Vitamin B12 (Cobalamin), welches beim gesunden Menschen von den Darmbakterien direkt aus Cobaltionen gebildet werden kann. Die benötigte Cobaltmenge ist extrem gering, nur etwa 0,2 Mikrogramm pro Tag. Während kleine Überdosen von Co-Verbindungen für den Menschen nur wenig giftig sind, führen größere Überdosen (ab etwa 25–30 Milligramm pro Tag) zu Haut-, Lungen-, Magenerkrankungen, Leber-, Herz-, Nierenschäden und Krebsgeschwüren. Als man in Kanada früher Biere zur Schaumstabilisierung mit Cobalt anreicherte, stieg die Mortalitätsrate bei starken Biertrinkern auf annähernd 50 % an – bedingt durch Herzmuskelschwäche („kanadisches Biertrinkerherz“). Heute wird dem Bier jedoch kein Cobalt mehr zugesetzt.[15]
Nachweis
Eine relativ aussagekräftige Vorprobe für Cobalt ist die Phosphorsalzperle, die von Cobaltionen intensiv blau gefärbt wird. Im Kationentrennungsgang kann es neben Nickel mit Thiocyanat und Amylalkohol nachgewiesen werden, es bildet beim Lösen im Amylalkohol blaues Co(SCN)2.
Quantitativ kann Cobalt mit EDTA in einer komplexometrischen Titration gegen Murexid als Indikator bestimmt werden.[16]
Verbindungen
Cobalt tritt in seinen Verbindungen meist zwei- oder dreiwertig auf; diese Verbindungen besitzen oft kräftige Farben.
Wichtige Cobaltverbindungen:
- Cobalt(II)-chlorid
- Thénards Blau
- Rinmanns Grün
- Cobaltoxide, wie Cobalt(II)-oxid oder Cobalt(II,III)-oxid
- Cobalt(II)-sulfat
- Cobalt(II)-silicat
- Cobaltgelb
Siehe auch
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7440-48-4 im European chemical Substances Information System ESIS
- ↑ Joachim Heimannsberg: Brockhaus! Was so nicht im Lexikon steht. ISBN 3-7653-1551-6, S. 255–256.
- ↑ a b c dtv-Atlas Chemie. Band 1, dtv-Verlag 2000.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH Verlagsgesellschaft, 1988.
- ↑ Mineralienatlas:Kobaltnickelkies (Wiki).
- ↑ Cobalt bei USGS Mineral Resources.
- ↑ a b Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 91.–100. Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1146–1152.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics A 729, 2003, S. 3–128.
- ↑ Cobalt-60 bei HyperPhysics, Georgia State University.
- ↑ Cobalt-60 bei Centers for Disease Control and Prevention (CDC), Atlanta, USA, 2004, eingesehen am 21. Februar 2009.
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1681.
- ↑ Cobalt bei rutherford-online - Lexikon der Elemente 2006.
- ↑ Christian Schwägerl: Strahlenschrott wurde über ganz Deutschland verteilt. Auf: Spiegel online. 17. Februar 2009.
- ↑ Chien-Shiung Wu: Experimental Test of Parity Conservation in Beta Decay. In: Physical Reviews 105, 1957, S. 1413-1415 (doi:10.1103/PhysRev.105.1413)
- ↑ Expert Group on Vitamins and Minerals, 2002.
- ↑ Komplexometrische Bestimmungen mit Titriplex (Hrsg. von E. Merck, Darmstadt).
Literatur
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102. Auflage, 2007, de Gruyter Berlin, ISBN 978-3-11-017770-1.
- Hans Breuer: dtv-Atlas Chemie (1. Band, 9. Auflage), dtv, München 2000, ISBN 3-423-03217-0.
- M. Binnewies: Allgemeine und Anorganische Chemie (1.Auflage). Spektrum Verlag., Heidelberg 2004, ISBN 3-8274-0208-5.
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
- Mineralienatlas:Kobalt (Wiki)
- The Cobalt Development Institute
- ReinstCobalt >99,9% als Bild in der Sammlung von Heinrich Pniok
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.