- Dichloressigsäure
-
Strukturformel 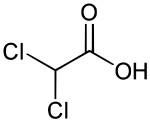
Allgemeines Name Dichloressigsäure Andere Namen - Dichlorethansäure
- DCA
Summenformel C2H2Cl2O2 CAS-Nummer 79-43-6 PubChem 6597 Kurzbeschreibung farblose Flüssigkeit mit stechendem Geruch[1]
Eigenschaften Molare Masse 128,94 g·mol–1 Aggregatzustand flüssig
Dichte 1,57 g·cm−3 (20 °C)[2]
Schmelzpunkt Siedepunkt 194 °C[2]
Dampfdruck pKs-Wert 1,29[3]
Löslichkeit Brechungsindex 1,4653–1,4673 [4]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [5] 

Gefahr
H- und P-Sätze H: 314-400 EUH: keine EUH-Sätze P: 273-280-305+351+338-310 [6] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [5] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 35-50 S: (1/2)-26-45-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Dichloressigsäure (kurz DCA, von engl. Dichloroacetic Acid) ist eine chlorierte Carbonsäure, bei der zwei Wasserstoffatome der Methylgruppe durch zwei Chloratome substituiert sind. Die Salze werden als Dichloracetate bezeichnet.
Inhaltsverzeichnis
Vorkommen
Dichloressigsäure kann in gechlortem Trinkwasser bei Kontakt mit organischer Materie entstehen.[8][9]
Gewinnung und Darstellung
Dichloressigsäure kann aus Trichloressigsäure oder bei der Reaktion von Essigsäure mit Chlor gewonnen werden, wobei allerdings ein Gemisch von Mono-, Di- und Trichloressigsäure entsteht, das nur schwer aufzutrennen ist. Ein direkter Zugang ergibt sich über die Umsetzung von Chloralhydrat und Kaliumcyanid oder Kaliumhexacyanidoferrat(II) in wässriger Lösung durch Kochen unter Rückfluss.[10]
Verwendung
Dichloressigsäure wird als Lösungsmittel sowie als Ausgangsstoff zur Synthese anderer Chemikalien (etwa Sulfonamide[11]) benutzt.
Arzneistoff
In klinischen Studien wird die Anwendung von Dichloracetat als Arzneistoff bei der Stoffwechselerkrankung Laktatazidose geprüft, da es die Enzym-eigene Kinase des Enzymkomplexes Pyruvat-Dehydrogenase inhibiert.
Seit einer wissenschaftlichen Veröffentlichung im Januar 2007[12] ist ein Einsatz als Arzneistoff auch gegen spezielle Krebsformen Gegenstand von Untersuchungen.[13] Für eine kommerzielle Vermarktung als Arzneistoff gegen Krebs, liegen bisher keine ausreichenden Belege für die klinische Wirksamkeit und Sicherheit vor. Eine Studie musste wegen schwerer peripherer Nervenschädigungen abgebrochen werden. Die Universität von Alberta, Canada, hat jedoch im September 2007 die Erlaubnis zu einer weiteren klinischen Studie zur Anwendbarkeit von Dichloressigsäure als Arzneistoff gegen Krebs erhalten.[14] Aufgrund fehlender Patentierbarkeit ist die Finanzierung klinischer Studien sehr schwierig[15], da insofern kein finanzieller Anreiz für Pharmakonzerne besteht.
Einzelnachweise
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e Eintrag zu Dichloressigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9.12.2007 (JavaScript erforderlich).
- ↑ a b Lawrence H. Keith,Douglas B. Walters; The National Toxicology Program's Chemical Data Compendium; ISBN 978-0-87371-716-8
- ↑ Stoffdaten bei chemexper.com.
- ↑ a b Eintrag zu CAS-Nr. 79-43-6 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Dichloroacetic acid bei Sigma-Aldrich, abgerufen am 24. März 2011.
- ↑ a b AMA Archives of Industrial Hygiene and Occupational Medicine. Vol. 4, Pg. 119, 1951.
- ↑ Greenfacts: Dichloroacetic acid.
- ↑ WHO: Dichloroacetic Acid in Drinking-water.
- ↑ Ernst Albert Schmidt; Ausführliches Lehrbuch der pharmaceutischen Chemie; ASIN B0039XQEFA.
- ↑ International Agency for Research on Cancer: Dichloroacetic acid.
- ↑ Small molecule offers big hope against cancer, University of Alberta Express News, 16. Januar 2007.
- ↑ NZZ online: Krebszellen unter Zwangsbeatmung. 4. April 2007.
- ↑ University of Alberta: News.
- ↑ FAZ Community Blogs: Altes Molekül als Krebsmedikament?.
Wikimedia Foundation.
