- HCl
-
Strukturformel 
Allgemeines Name Chlorwasserstoff Andere Namen - Salzsäure wasserfrei
- Hydrogenchlorid
- Salzsäuregas
- Wasserstoffchlorid
Summenformel HCl CAS-Nummer 7647-01-0 PubChem 313 Kurzbeschreibung farbloses, stechend riechendes Gas Eigenschaften Molare Masse 36,46 g·mol–1 Aggregatzustand gasförmig
Dichte 1,64 kg·m–3 (Gasdichte, 0 °C)[1]
Schmelzpunkt Siedepunkt -85,03 °C[1]
Dampfdruck Löslichkeit 720 g/l in Wasser (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Ätzend (T) (C) R- und S-Sätze R: 23-35 S: (1/2)-9-26-36/37/39-45 MAK 3,0 mg·m–3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chlorwasserstoff (systematisch auch als Wasserstoffchlorid oder Hydrogenchlorid bezeichnet) ist ein farbloses, stechend riechendes Gas, das in Wasser gelöst Salzsäure (Chlorwasserstoffsäure) bildet. Die Summenformel lautet HCl.
Inhaltsverzeichnis
Gewinnung und Darstellung
Hergestellt wird Chlorwasserstoff im Labor aus konzentrierter Schwefelsäure und Natriumchlorid:
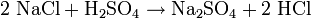
- Natriumchlorid und Schwefelsäure reagieren zu Natriumsulfat und Chlorwasserstoff
Statt der Verwendung von Schwefelsäure kann auch Natriumhydrogensulfat benutzt werden. Dazu wird ein Gemisch aus Natriumchlorid und Natriumhydrogensulfat trocken erhitzt. Um die Reaktion in Gang zu halten, muss hierbei das entstehende Chlorwasserstoffgas abgeführt werden.
In der chemischen Industrie fällt Chlorwasserstoff hauptsächlich als Nebenprodukt bei der Chlorierung organischer Verbindungen an oder wird mit der Chlorknallgasreaktion (Zündung eines Gemisches aus Wasserstoff und Chlor beispielsweise durch Belichtung) gewonnen.
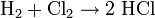
- Wasserstoff und Chlor reagieren zu Chlorwasserstoff
Eigenschaften
Die systematische Bezeichnung Wasserstoffchlorid bringt mit der Silbe -chlorid zum Ausdruck, dass das Chloratom in der Molekülverbindung eine negative Partialladung trägt, ähnlich wie nach Chloridionen, die eine negative Ionenladung besitzen.
Chlorwasserstoff hat eine leicht höhere Dichte als Luft. In einem Liter Wasser lösen sich bei 0 °C unter Erwärmung 520 l, das entspricht 850 g HCl-Gas, Bei 20 °C lösen sich in einem Liter Wasser 442 Liter Chlorwasserstoff. An feuchter Luft bildet HCl-Gas Nebel aus feinen Salzsäure-Tröpfchen.
Seine Wärmekapazität cp beträgt 799 J/(kg K).
Biologische Bedeutung
Chlorwasserstoff ist Hauptbestandteil der Magensäure allesfressender Tiere und bewirkt auch im menschlichen Magen die Denaturierung der Nahrung. Ein Großteil des vom Menschen aufgenommenen Kochsalzes wird im Körper in Salzsäure umgewandelt.
Verwendung
Neben der vielfältigen Verwendung als Säure findet reiner Chlorwasserstoff Verwendung als Chlorierungsmittel in der Oxychlorierung von Ethen zu Vinylchlorid.
Sicherheitshinweise
Chlorwasserstoff ist ätzend und in hohen Konzentrationen giftig. Vergiftungen sind jedoch sehr selten. Beim Einatmen können Reizungen der Schleimhäute und der Atemwege auftreten, die zu einer akuten Bronchitis oder Lungenentzündung führen können. Bei Kontakt mit Haut und Kleidung lässt sich die Säure mit Wasser gut und restlos auswaschen.
Quellen
- ↑ a b c d e f Eintrag zu Chlorwasserstoff in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12.11.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7647-01-0 im European chemical Substances Information System ESIS
Halogenwasserstoffe und zugehörige SäurenHalogenwasserstoffe: Fluorwasserstoff | Chlorwasserstoff | Bromwasserstoff | Iodwasserstoff | Astatwasserstoff
Halogenwasserstoffsäuren: Fluorwasserstoffsäure | Salzsäure | Bromwasserstoffsäure | Iodwasserstoffsäure
Wikimedia Foundation.