- Hydroxybutandisäure
-
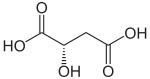
Strukturformel 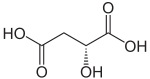
D-Äpfelsäure L-ÄpfelsäureAllgemeines Name Apfelsäure Andere Namen - (S)-Äpfelsäure
- (R)-Äpfelsäure
- (RS)-Äpfelsäure
- L-Äpfelsäure
- D-Äpfelsäure
- DL-Äpfelsäure
- 2-Hydroxybutandisäure
- 2-Hydroxybernsteinsäure
- 2-Hydroxyethan-1,2-dicarbonsäure
- E 296
Summenformel C4H6O5 CAS-Nummer - 97-67-6 (L-Äpfelsäure)
- 636-61-3 (D-Äpfelsäure)
- 6915-15-7 (DL-Äpfelsäure)
Eigenschaften Molare Masse 134,09 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36 S: keine S-Sätze LD50 1600 mg·kg−1 (Maus, oral) [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Äpfelsäure (auch Apfelsäure oder 2-Hydroxybernsteinsäure) ist eine Dicarbonsäure, die als rechtsdrehende D-Äpfelsäure und als linksdrehende L-Äpfelsäure vorkommt. Die L-Form ist ein Zwischenprodukt im Citratzyklus. In der Natur ist L-Äpfelsäure in unreifen Äpfeln, Quitten, Weintrauben, Berberitzenbeeren, Vogelbeeren und Stachelbeeren enthalten. Die Salze der Äpfelsäure heißen Malate (von lateinisch malus = Apfel).
Inhaltsverzeichnis
Historisches
L-Äpfelsäure wurde 1785 von Carl Wilhelm Scheele aus Apfelsaft isoliert und beschrieben.
Eigenschaften
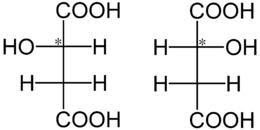
Die Äpfelsäure besitzt ein Stereozentrum (*) und ist deshalb optisch aktiv. Unten dargestellt sind die L-Äpfelsäure (links) und die D-Äpfelsäure (rechts) in der Fischerprojektion:
Wie alle Enantiomeren besitzen die L-Äpfelsäure und die D-Äpfelsäure, mit Ausnahme der Richtung des Drehwertes α die gleichen physikalischen Eigenschaften. Die physikalischen Eigenschaften (Beispiel: Schmelzpunkt) von DL-Äpfelsäure, ein Racemat, unterscheiden sich deutlich von denen der reinen Enantiomeren L-Äpfelsäure und D-Äpfelsäure.Verwendung
Als Lebensmittelzusatzstoff (E 296) darf sowohl die natürliche L-Form als auch die synthetische D-Form oder das Racemat verwendet werden. In der Praxis ist ihre Verwendung aufgrund des relativ hohen Preises eher gering. Stattdessen werden meist günstigere Alternativen, wie Citronensäure (E 330), Natriumbenzoat (E 211) oder auch Phosphorsäure (E 338) verwendet. Als Zusatzstoff in Kartoffelchips werden Natriummalat (E 350), Kaliummalat (E 351) und Calciummalat (E 352) verwendet. In der Medizin wird Kaliummalat bei Hypokaliämie als Infusionslösung eingesetzt, falls Kaliumchlorid wegen gleichzeitig bestehender Hyperchlorämie nicht eingesetzt werden kann.
Herstellung
Die L-Äpfelsäure und ihre Salze (Malate) werden nach einem biotechnologischen Verfahren, katalysiert durch das Enzym Fumarat-Hydratase, aus Fumarsäure (E 297) beziehungsweise als Stoffwechselprodukt von Bakterien und Pilzen (z. B. Brevibacterium, Corynebacterium, Escherichia, Microbacterium, Proteus, Pichia) gewonnen.[4] Die enantiospezifische Anlagerung von Wasser an Maleinsäure wird durch die Maleat-Hydratase katalysiert und führt zu D-Äpfelsäure.[4]. Racemische Äpfelsäure kann durch die Bildung diastereomerer Salze mit einem geeigneten enantiomerenreinen Amin in L-Äpfelsäure und D-Äpfelsäure gespalten werden.
Weinbau
Äpfelsäure ist auch in Weintrauben enthalten und wird beim Verkosten von Wein meist als herb-sauer wahrgenommen. Bei der Lagerung des Weines kommt es zur sogenannten Äpfelsäuregärung, welche den Geschmack des Weines abrundet. Verantwortlich für diesen langwierigen Prozess, der auch noch nach dem Abfüllen des Weins fortschreitet, ist das Milchsäurebakterium Oenococcus oeni.
Quellen
- ↑ a b c Eintrag zu CAS-Nr. 6915-15-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 06.01.2008 (JavaScript erforderlich)
- ↑ a b c d e The Merck Index, 9. Auflage, 1976, ISBN 0-9-11910-26-3, S. 741.
- ↑ Malic acid bei ChemIDplus
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acte, 2006, ISBN 3-906390-29-2, S. 362-370.
Weblinks
Siehe auch
Wikimedia Foundation.