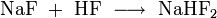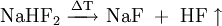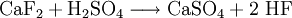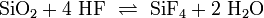- Kriechprobe
-
Fluoride sind die Salze der Fluorwasserstoffsäure (HF), die auch als Flusssäure bekannt ist. Sie enthalten in ihrem Ionengitter als negative Gitterbausteine (Anionen) Fluorid-Ionen (F−). Daneben werden auch kovalente, nicht-ionische Verbindungen von Nichtmetallen sowie organische Fluorverbindungen wie etwa die Fluorkohlenwasserstoffe oder Carbonsäurederivate veraltet als Fluoride bezeichnet.
Inhaltsverzeichnis
Natürliches Vorkommen
Fluoride kommen in Form vieler Mineralien in der Natur vor. Wichtigster Vertreter ist der Fluorit (CaF2), ferner Yttrofluorit, ein Additions-Mischkristall mit YF3, und Cerfluorit (auch Yttrocerit), der neben Yttrium noch Cer, Erbium und Hydratwasser enthält. Weitere Fluoride sind Frankdicksonit (BaF2), Gagarinit (NaCaYF6), Tysonit (auch Fluocerit, (Ce,La,Se)F3) und Neighborit (NaMgF3). Komplexe Fluoride enthalten ein weiteres Element innerhalb eines Anion-Komplexes, wie etwa Bor, Aluminium oder Silicium, und bilden dann z. B. Hexafluorosilikate oder Tetrafluorborate. Vertreter sind hier das Ferruccit (NaBF4), Avogadrit ((K,Cs)BF4), Malladrit (Na2SiF6), Hieratit (K2SiF6), Kryolithionit (Na3Al2Li3F12), Kryolith (Na3AlF6), Elpasolith (K2Na[AlF6]), Jarlit (NaSr2[AlF6]2), Usovit (Ba2Mg[AlF6]2) und Weberit (Na2MgAlF7).[1]
- siehe auch: Kategorie Fluormineralien
Vertreter
Wichtige salzartige Fluoride
Einige wichtige Fluoride sind:
- Aluminiumfluorid (AlF3),
- Ammoniumfluorid (NH3 x HF = NH4F),
- Calciumfluorid (Flussspat, CaF2),
- Natriumfluorid (NaF),
- Uranhexafluorid (UF6).
Hydrogendifluoride
Neben den einfachen Fluoriden existieren auch Hydrogendifluoride der Zusammensetzung Me+[HF2]-, wie etwa Natriumhydrogendifluorid (NaHF2) und Kaliumhydrogendifluorid (KHF2). Diese enthalten das lineare [FHF]--Anion. Darstellung ist aus wässrigen Lösungen der Fluoride unter Anwesenheit eines Überschusses Fluorwasserstoff (HF) möglich. Beim Erhitzen spalten die Hydrogendifluoride den Fluorwasserstoff wieder ab.[2]
Darstellung:
Zersetzung durch Erhitzen:
Kovalente und organische Fluoride
- Fluorsulfonsäure (FHO3S)
- Schwefelhexafluorid (SF6),
- Sarin (C4H10FO2P),
- Tetrafluormethan (CF4)
- Aminfluoride.
Nachweis
Physikalische Analyseverfahren
Professionell werden heute Fluoride in Mineralien und Feststoffen mit Röntgenfluoreszenzanalyse, Röntgenbeugung oder Massenspektrometrie bestimmt, in Flüssigkeiten mit Fluorid-Elektroden, IR- oder NMR-Verfahren.[3]
Nasschemisch
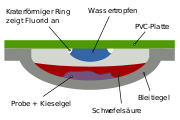
Mit einfachen Labormethoden lässt sich Fluorid durch den Bleitiegeltest oder die Ätzprobe nachweisen. Versetzt man mit Schwefelsäure, so entsteht Fluorwasserstoff, der das Glasbehältnis anätzt.
Gibt man die Probe in einen Bleitiegel mit gepulverter Kieselsäure oder Natriumsilicat und überschichtet anschließend Schwefelsäure, so bildet sich Siliciumtetrafluorid-Gas:
Der Tiegel wird wieder verschlossen und die Abdeckung mit Wasser befeuchtet. Das Siliciumtetrafluoid reagiert mit dem Wasser wieder zu Silicat, das sich kraterförmig im Wassertropfen absetzt.[4]
Anwendungen
Man verwendet Fluoride unter anderem um Kraftstoffbehälter zu versiegeln (Gasdicht). Dabei werden die Kunststofftanks aus z. B. PA (Polyamid) mit dem gelösten Fluorid bedampft, dadurch diffundiert dieses ca 3–4 Mikrometer in die Oberfläche ein.
Als Fluoridierung bezeichnet man die Zugabe von Fluoriden insbesondere zu Speisesalz, Trinkwasser, Milch, Tabletten und Zahnpasten zur Prophylaxe von Zahnkaries.
Toxikologie
Wasserlösliche Fluoride sind als giftig eingestuft. Die Giftwirkung beruht dabei teils aus der Ausfällung des vom Stoffwechsel benötigten Calcium als Calciumfluorid, teils aus der Wirkung als Protoplasma- und Zellgift, das bestimmte Enzymsysteme und die Proteinsynthese hemmt.
Bei oraler Aufnahme erfolgt eine schnelle und nahezu vollständige Resorption löslicher Fluoride über die Magenschleimhaut, da die Salze durch die Salzsäure des Magens Fluorwasserstoff bilden. Akute Symptome sind starke Schmerzen in Magen und Darm, hinter dem Brustbein, Krämpfe, Bewusstlosigkeit und schwere Stoffwechselstörungen. Fluorwasserstoff verursacht ebenfalls starke Verätzungen bis zur Zerstörung von Zellen.
Eine chronische Aufnahme auch geringer Mengen kann zu einer Vergiftung (Fluorose) führen, die sich in Schädigungen des Skeletts, der Zähne, der Lungenfunktion, der Haut und in Stoffwechselstörungen äußert. [5]
Wasserunlösliche oder schwerlösliche Fluoride wie Calciumfluorid und Aluminiumfluorid besitzen eine wesentlich geringere Toxizität. Es besteht jedoch immer die Gefahr der Bildung des ebenfalls hochtoxischen Fluorwasserstoffs beim Kontakt mit starken Säuren.
Siehe auch
- Chloride, Bromide, Iodide, Fluorit
- Fluoridierung, die Zähne betreffend (ausführlicher Artikel)
- Aminfluoride
Einzelnachweise
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Fluoride, In: Lexikon der Geologie, abgerufen 10. Juli 2008
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Fluoride, In: Lexikon der Chemie, abgerufen 10. Juli 2008
- ↑ Chemiker-Standard-Wissen, 2000
- ↑ Biltz-Klemm-Fischer, 1966
- ↑ Eintrag zu Fluoride in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10. Jul. 2008 (JavaScript erforderlich)
Weblinks
Wikimedia Foundation.