- Magnesiumphosphat
-
Strukturformel Mg2+ 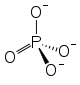
Allgemeines Name Magnesiumhydrogenphosphat Andere Namen - Magnesiumphosphat
- Magnesiumphosphat, sekundär
- Magnesium phosphoricum
- phosphorsaures Magnesia
Summenformel MgHPO4·3H2O CAS-Nummer 7782-75-4 Kurzbeschreibung feines, weißes Pulver Eigenschaften Molare Masse 174,34 g/mol Aggregatzustand fest[1]
Dichte 2,12 g/cm3[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22 S: 36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumphosphate sind phosphorsaure Salze des Magnesiums. Der typischste Vertreter ist das Magnesiumhydrogenphosphat, auch phosphorsaures Magnesia genannt. Es besitzt die Formel MgHPO4 · 3 H2O und gehört zur Stoffgruppe der Hydrogenphosphate.
Inhaltsverzeichnis
Eigenschaften
Magneiumhydrogenphosphat ist ein farbloses, kristallines Pulver, das aufgrund seines unedelen Charakters in der Natur nicht in reiner Form vorkommt. Dies trifft auch für andere Magnesiumphosphatderivate zu.
Beschreibung
Magnesiumhydrogenphosphat wird industriell aus Natriumphosphat und Magnesiumsulfat-Heptahydrat gewonnen. Es löst sich in Wasser nur schwer, aber in verdünnten Säuren gut. Ab einer Temperatur von 205 Grad Celsius zersetzt es sich unter Abgabe von Wasser und Magnesiumpyrophosphat (Mg2P2O7).
Derivate
Magnesiumphosphate existieren auch in anderen Konstellationen:
- Trimagnesiumphosphat Mg3(PO4)2
-
- Molare Masse: 262,88; weißes, wasserunlösliches Pulver
- Magnesiumdihydrogenphosphat Mg(H2PO4)2
-
- Molare Masse: 218,28; hygroskopisches, weißes, wasserlösliches Pulver.
- Magnesiumdiphosphat Mg2P2O7
-
- Molare Masse: 222,57; weißes, wasserunlösliches Pulver, auch Magnesiumpyrophosphat genannt.
Vorkommen
im menschlichen Körper
in Lebensmittel
- In allem grünem Gemüse (Bestandteil des Blattgrüns), Obst (z. B. Bananen), Getreide
Verwendung
Magnesiumphosphate werden in der Industrie als keramischer Rohstoff und als Flammschutzmittel angewendet. In der Lebensmittelindustrie wird es als Futtermittelzusatz und Abführmittel eingesetzt, weiterhin als Säureregulator und/oder Trennmittel. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 343 zugelassen.
Spezielle Anwendungen finden Magnesiumsalze in der Alternativmedizin, beispielsweise als Schüßler-Salze. Das siebte der Schüßler-Salze „Magnesium phosphoricum D6“ soll nach dem Arzt Wilhelm Heinrich Schüßler Krämpfe lindern und Schmerzen beruhigen. Als einziges Schüsslersalz-Mittel wird es in heißem Wasser gelöst und schluckweise eingenommen. Aufgrund dieser Einnahme erhielt dieses Mittel im Volksmund den Beinamen „Heiße Sieben“.
Das homöopathische Arzneimittel „Magnesium phosphoricum (Mag-p)“ ist nur unvollständig von Dr. Henry Clay Allen und Kollegen geprüft und 1889 in Medical Advances veröffentlicht worden. Im Laufe der Zeit wurde es von anderen Homöopathen erweitert. Die Hauptindikationen des homöopathischen Arzneimittel „Magnesium phosphoricum“ sind Nervenschmerzen und Muskelkrämpfe.
Eine über den Placebo-Effekt hinausgehende Wirkung ist allerdings nicht nachweisbar.
Quellen
- Homöopathisches Repertorium, Deutsche Homöopathie Union (DHU).
- Carlo Odermatt + Sven Hartmann + Beat Ernst, Homöopathie Arzneimittelbilder, K2-Verlag, 2004, ISBN 3-03722-950-0.
- Mohinder Singh Jus, Praktische Materia Medica. Arzneimittellehre von A-Z, Homöosana, 2004, ISBN 3906407055.
- Andrew Lockie, Das große Lexikon der Homöopathie, Dorling Kindersley Verlag, 2000, ISBN 3831000050.
Siehe auch
Quellen
Weblinks
- Schüßler-Salz „Magnesium phosphoricum“
- Homöopathisches Arzneimittelbild „Magnesium phosphoricum (Mag-p)“
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
