- Mangan(II)-oxid
-
Kristallstruktur 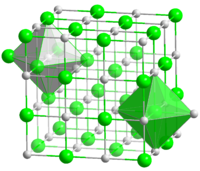
__ Mn2+ __ O2- Allgemeines Name Mangan(II)-oxid Andere Namen - Manganoxid
- Manganmonoxid
- Mangangrün
- Manganoxidul (veraltet)
- Manganosit (Mineral)
Verhältnisformel MnO CAS-Nummer 1344-43-0 PubChem 14940 Kurzbeschreibung grünes Pulver[1]
Eigenschaften Molare Masse 70,94 g·mol–1 Aggregatzustand fest
Dichte 5,45 g·cm–3[1]
Schmelzpunkt Löslichkeit - unlöslich in Wasser[1]
- löslich in Säuren und Ammoniumchlorid[[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302-312-332-315-319-335 EUH: keine EUH-Sätze P: 261-302+352-305+351+338-321-405-501 [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22-36/37/38 S: 26-36 MAK 0,5 mg·m–3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Mangan(II)-oxid ist eines der Oxide des Mangans mit der Formel MnO.
Inhaltsverzeichnis
Vorkommen
Manganoxid kommt in der Natur im Mineral Manganosit[3][4] vor.
Gewinnung und Darstellung
Mangan(II)-oxid wird durch Reduktion von Mangan(IV)-oxid-haltigen Erzen mit Erdgas oder Kohle bei Temperaturen zwischen 400° bis 1000°C hergestellt. Gebildetes Mangan(II)-oxid muss unter Schutzgas abgekühlt werden, um eine Rückoxidation zum vierwertigen Mangan zu vermeiden.
- MnO2 + CO → MnO + CO2
- MnO2 + H2 → MnO + H2O
Mangan(II)-oxid kann auch durch Erhitzung von Mangan(II)-carbonat MnCO3 im Vakuum gewonnen werden:[5]
- MnCO3 → MnO + CO2
Eigenschaften
Physikalische Eigenschaften
Mangan(II)-oxid ist ein antiferromagnetischer Isolator und besitzt eine kubische NaCl–Kristallstruktur, die aufgrund der speziellen Anordnung der magnetischen Momente rhomboedrisch in [111] Richtung verzerrt ist. Oberhalb der Néel-Temperatur von 110 K wird Mangan(II)-Oxid paramagnetisch.[6]
Verwendung
Mangan(II)-oxid wird als Bestandteil von Gießpulver [7] in der metallverarbeitenden Industrie, als Düngemittelzusatz[8] bzw. Futtermittelzusatzstoff, sowie als grünes Farbpigment beim Zeugdruck verwendet.
Sicherheitshinweise
Pulverförmiges, frisch hergestelltes Mangan(II)-oxid kann sich an der Luft selbst entzünden.[1]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Mangan(II)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 09.01.2008 (JavaScript erforderlich)
- ↑ Manganese & compounds: Overview (National Pollutant Inventory Australien)
- ↑ Manganosit (Mineralienatlas)
- ↑ Die Entdeckung von Manganosit im Harz (Stollentroll)
- ↑ W.H. McCarroll (1994) Oxides- solid sate chemistry, Encyclopedia of Inorganic chemistry Ed. R. Bruce King, John Wiley & Sons ISBN 0471936200
- ↑ Magnetisches Moment (Uni-Düsseldorf)
- ↑ G. Gigacher, Ch. Bernhard und W. Kriegner; Eigenschaften hochmanganhaltiger Stähle unter stranggießähnlichen Bedingungen
- ↑ Mangan und seine Verbindungen (Uni Regensburg)
Kategorien:- Gesundheitsschädlicher Stoff
- Oxid
- Manganverbindung
Wikimedia Foundation.
