- Phenethylamin
-
Strukturformel 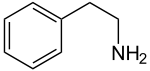
Allgemeines Name Phenethylamin Andere Namen - β-Phenylethylamin
- 2-Phenylethylamin
- 2-Phenyl-1-aminoethan
Summenformel C8H11N CAS-Nummer 64-04-0 PubChem 1001 Kurzbeschreibung Eigenschaften Molare Masse 121,18 g·mol−1 Aggregatzustand flüssig
Dichte 0,96 g·cm−3 (20 °C) [1]
Schmelzpunkt Siedepunkt 200–202 °C [1]
Dampfdruck Löslichkeit schlecht in Wasser (4,3 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 301-314 EUH: keine EUH-Sätze P: 280-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 22-34-52 S: 26-36/37/39-45-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenethylamin, auch β-Phenylethylamin (PEA) oder mit korrekter chemischen Bezeichnung 2-Phenylethylamin, ist als Vorläufer der Benzylisochinolin-Alkaloide in Pflanzen weit verbreitet. Phenethylamin kommt im Bittermandelöl und in Kakaobohnen vor. Es wurde auch im Gehirn und im Harn nachgewiesen. Das biogene Amin Phenethylamin als Stammsubstanz der Catecholamine und vieler Halluzinogene wird mit dem Entstehen von Lust- und Glücksempfindungen in Verbindung gebracht.[2] Phenethylamin wird durch Monoaminoxidasen (MAO) abgebaut.[5]
Phenylethylamin ist die Stammsubstanz der Stoffgruppe der Phenylethylamine.
Inhaltsverzeichnis
Chemie
Synthese
Phenethylamin ist eine natürliche Verbindung, die durch enzymatische Decarboxylierung aus der Aminosäure Phenylalanin biosynthetisiert wird. In einer weiteren möglichen Synthesevariante wird Benzaldehyd mit Nitromethan zum Nitrostyrol kondensiert. Die Hydrierung ergibt PEA.
Strukturbetrachtung
Homologe: Das nächsthöhere Seitenketten-Homologe ist das Amphetamin (-β-ethyl versus -isopropyl), weitere Homologe sind bekannt. Meskalin ist ein Beispiel für ein Phenylkern-Derivat (3,4,5-Trimethoxy-substituiert). Gleichzeitig Kern- und Seitenketten-substituiert ist beispielsweise das Noradrenalin. Zusammengefasst werden diese vielfältigen Strukturvarianten in der Stoffgruppe der Phenylethylamine dargestellt.
Wirkung
Aufgenommenes PEA hat bei Menschen keinerlei Wirkung. Sogar in Dosen von 1600 mg oral und 50 mg intravenös zeigt sich kein Effekt.[6] Der Grund dafür mag darin liegen, dass PEA im menschlichen und tierischen Körper schnell abgebaut wird.[7]
Patienten die (zur Behandlung einer Depression) einen Monoaminooxidase-Hemmer nehmen, sollten die Aufnahme von PEA meiden, da dies zu einem starken Blutdruckanstieg und Kopfschmerzen führt.[8]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Phenethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juli 2011 (JavaScript erforderlich)
- ↑ a b Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ a b Datenblatt Phenethylamine bei Sigma-Aldrich, abgerufen am 18. April 2011.
- ↑ Phenethylamin bei ChemIDplus
- ↑ T. Nagatsu: Progress in monoamine oxidase (MAO) research in relation to genetic engineering. In: Neurotoxicology Band 25, Nummer 1–2, Januar 2004, S. 11–20, ISSN 0161-813X. doi:10.1016/S0161-813X(03)00085-8. PMID 14697876. (Review).
- ↑ Alexander Shulgin, PIHKAL, S. 815ff
- ↑ O. Suzuki, Y. Katsumata, M. Oya: Oxidation of beta-phenylethylamine by both types of monoamine oxidase: examination of enzymes in brain and liver mitochondria of eight species. In: Journal of neurochemistry Band 36, Nummer 3, März 1981, S. 1298–1301, ISSN 0022-3042. PMID 7205271.
- ↑ Fachinformation von Jatrosom, Stand März 2005
Literatur
- Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story. Transform Press, ISBN 0-9630096-0-5
Weblinks
Wikimedia Foundation.
