- Pyrogallol
-
Strukturformel 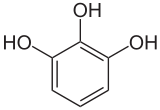
Allgemeines Name Pyrogallol Andere Namen - 1,2,3-Trihydroxybenzol
- vic. Trihydroxybenzol
- Pyrogallussäure
- Brenzgallussäure
Summenformel C6H6O3 CAS-Nummer 87-66-1 PubChem 1057 Kurzbeschreibung farblose, glänzende Blättchen oder Nadeln[1]
Eigenschaften Molare Masse 126,11 g·mol−1 Aggregatzustand fest
Dichte 1,45 g·cm−3 [2]
Schmelzpunkt Siedepunkt 309 °C[2]
Dampfdruck pKs-Wert 9,01[3]
Löslichkeit - gut in Wasser (400 g·l−1 bei 20 °C)[2]
- löslich in Ethanol und Diethylether[1]
- schlecht in Chloroform und Benzol[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 

Achtung
H- und P-Sätze H: 341-332-312-302-412 EUH: keine EUH-Sätze P: 201-273-308+313 [2] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22-68-52/53 S: (2)-36/37-61 LD50 780 mg·kg−1 (Ratte, oral)[5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Pyrogallol (1,2,3-Trihydroxybenzol) ist ein Derivat des Benzols, ein dreiwertiges Phenol mit drei vicinalen Hydroxygruppen. Die beiden anderen Isomere sind Phloroglucin (1,3,5-Trihydroxybenzol) und Hydroxyhydrochinon (1,2,4-Trihydroxybenzol).
Inhaltsverzeichnis
Geschichte
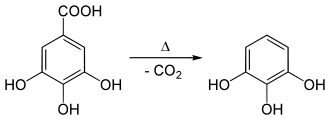
Pyrogallol wurde im Jahre 1786 zuerst von Carl Wilhelm Scheele durch Erhitzen von Gallussäure hergestellt, charakterisiert und benannt. Der Name leitet sich von griechisch pyr = Feuer und Gallol von Gallussäure her (-ol bezieht sich dabei auf die Hydroxy-(OH)-Gruppen und deutet auf die Herstellungsweise hin.
Gewinnung/Darstellung
Pyrogallol kann am einfachsten durch Pyrolyse von Gallussäure unter Decarboxylierung hergestellt werden.
Es entsteht auch bei der Zersetzung von Tanninen.
Eigenschaften
Pyrogallol besteht im Reinzustand aus weißen Kristallnadeln, die sich aber an der Luft schnell grau-bräunlich färben. Es ist ein starkes Reduktionsmittel und absorbiert begierig in alkalischer Lösung Sauerstoff aus der Luft; es komplexiert Metallionen (z. B. Fe3+ unter Blaufärbung). Bei längerem Stehen an der Luft (besonders in alkalischer Lösung) geht Pyrogallol durch Oxidation in Kohlenstoffdioxid, Essigsäure, Purpurogallin (Trihydroxybenztropolon) und weitere Zersetzungsprodukte über; die Lösung färbt sich dann dunkelbraun. Die wässrigen Lösungen reagieren aufgrund dieser Zersetzung allmählich saurer, daher stammt auch die Bezeichnung Pyrogallussäure, was jedoch für die Reinsubstanz kein zutreffender Name ist.
Verwendung
Es wurde zur quantitativen (mengenmäßigen) Sauerstoffanalyse eingesetzt und findet in der Holographie heute noch Verwendung. Nachdem es lange Zeit als fotografische Entwicklersubstanz kaum noch eingesetzt wurde, werden Entwickler mit Pyrogallol-Anteil heute wieder beliebter. Teilweise wird Pyrogallol neben BHT auch als Stabilisator für Substanzen wie Diethylether eingesetzt, die der Autooxidation durch Luftsauerstoff unterliegen.
Nachweis
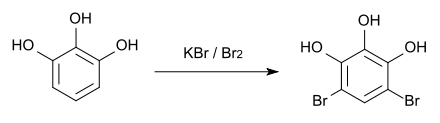
Zum qualitativ-analytischen Nachweis entsteht bei der Bromierung mit Kaliumbromid und Brom[6] das Dibromderivat, das einen Schmelzpunkt von 158 °C hat.[7]
Sicherheitshinweise
Pyrogallol ist gesundheitsschädlich. Es wird auch allmählich durch die Haut aufgenommen. Im Tierversuch wie auch beim Versuch an menschlichen Zellen konnten Veränderungen der DNA festgestellt werden.
Einzelnachweise
- ↑ a b c Ullrich Jahn, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f Eintrag zu CAS-Nr. 87-66-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Juli 2007 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Eintrag zu CAS-Nr. 87-66-1 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Pyrogallol bei Merck, abgerufen am 18. Januar 2011.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 653.
Wikimedia Foundation.