- 1,3-Indandion
-
Strukturformel 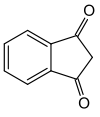
Allgemeines Name 1,3-Indandion Andere Namen - 1,3-Dioxoindan
- 1,3-Diketohydrinden
- 1,3-Hydrindendion
Summenformel C9H6O2 CAS-Nummer 606-23-5 PubChem 11815 Kurzbeschreibung Eigenschaften Molare Masse 146,14 g·mol−1 Aggregatzustand fest
Dichte 1,37 g·cm–3[3]
Schmelzpunkt Dampfdruck pKs-Wert 7,2 (18 °C)[6]
Löslichkeit gering löslich in Wasser[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [4] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,3-Indandion ist eine Diketon aus der Gruppe der bicyclischen aromatischen Kohlenwasserstoffe.
Inhaltsverzeichnis
Gewinnung und Darstellung
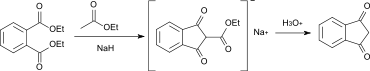
1,3-Indandion kann durch eine Claisen-Kondensation mit Diethylphthalat oder Dibutylphthalat als Ausgangsmaterial mit anschließender Hydrolyse und Decarboxylierung gewonnen werden.[7]
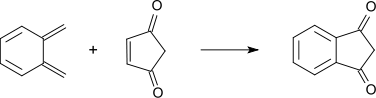
Die Synthese von 1,3-Indandion ist auch durch eine der Diels-Alder-Reaktion ähnliche Reaktion zwischen o-Xylylen und 4-Cyclopenten-1,3-dion möglich.[8]
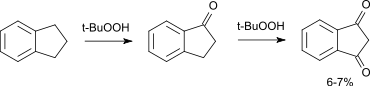
Die Oxidation von Indan mit Oxidationsmitteln wie z.B. Wasserstoffperoxid oder t-Butylhydroperoxid verläuft nur mit schlechten Ausbeuten, als Hauptprodukt entsteht dabei 1-Indanon.[9]
Eigenschaften
Physikalische Eigenschaften
Die Bildungsenthalpie von 1,3-Indandion in der Gasphase bei 298,15 K beträgt -165,0 ± 2,6 kJ/mol, die Schmelzenthalpie 17,2 kJ/mol und die Verdampfungsenthalpie 72,6 kJ/mol.[5]
Chemische Eigenschaften
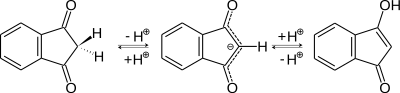
Im 1,3-Indandion-Molekül liegt eine Keto-Enol-Tautomerie vor[10]
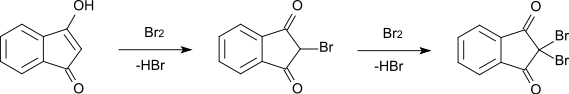
Die Bromierung von 1,3-Indandion zu 2-Brom-1,3-Indandion (CAS 7319-63-3, Schmelzpunkt 118-120 °C) verläuft über die Enolform unter Abspaltung von Bromwasserstoff. Auch eine weitere Bromierung zu 2,2-Dibrom-1,3-Indandion (Schmelzpunkt 181-182 °C) verläuft nach dem gleichen Mechanismus über die Enolform des Monobromderivats.[10]
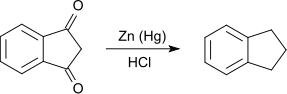
Die Reduktion von 1,3-Indandion nach Clemmensen mit amalgamiertem Zink in Salzsäure führt zum Indan. Als Nebenprodukt entsteht Inden.[11]
Katalytische ionische Hydrierung mit Triethylsilan und Trifluoressigsäure führt ebenfalls zum Indan.[12]
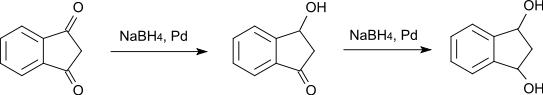
Wird die Reduktion mit Natriumborhydrid und Palladium als Katalysator durchgeführt, so geht die Reduktion nur bis zum 3-Hydroxy-1-indanon, bzw. in weiterer Folge zum 1,3-Indandiol.[13]
Auch die Reduktion mit Zinkstaub in Eisessig liefert 3-Hydroxy-1-indanon.[14]
Verwendung
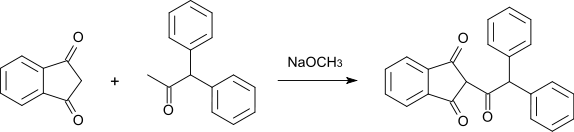
1,3-Indandion kann durch Reaktion mit 1,1-Diphenylaceton zu Diphacinon (einem Rodentizid) weiterverarbeitet werden.[15]
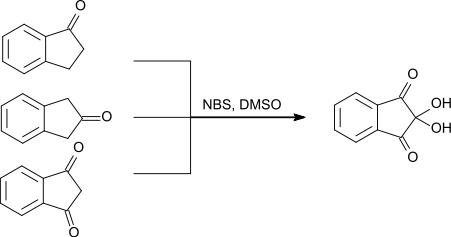
1,3-Indandion kann neben 1-Indanon und 2-Indanon als Ausgangsstoff zur Herstellung von Ninhydrin eingesetzt werden. Als weitere Reagenzien werden N-Bromsuccinimid und Dimethylsulfoxid eingesetzt.[16]
Verwandte Verbindungen
Einzelnachweise
- ↑ a b Datenblatt 1,3-Indandion bei AlfaAesar, abgerufen am 16. Juni 2011 (JavaScript erforderlich).
- ↑ a b Datenblatt 1,3-Indandion bei Acros, abgerufen am 16. Juni 2011.
- ↑ Datenblatt 2-Fluorpyridin bei TCI Europe, abgerufen am 27. Juni 2011.
- ↑ a b Datenblatt 1,3-Indandion bei Sigma-Aldrich, abgerufen am 20. Oktober 2010.
- ↑ a b c M. A. Matos, M. S. Miranda, M. J. Monte, L. M. Santos, V. M. Morais, J. S. Chickos, P. Umnahanant, J. F. Liebman: "Calorimetric and computational study of indanones", in: J. Phys. Chem. A, 2007, 111(43), S. 11153–11159. Volltext
- ↑ C. F. Bernasconi, P. Paschalis: "Kinetics of ionization of 1,3-indandione in methyl sulfoxide-water mixtures. Solvent effect on intrinsic rates and Broensted coefficients", in: J. Am. Chem. Soc., 1986, 108(11), S. 2969–2977 doi:10.1021/ja00271a027
- ↑ Synthesis of 1,3-indandione (cnki)
- ↑ D. B. Hansen and M. M. Joullie: "The development of novel ninhydrin analogues", in: Chem. Soc. Rev., 2005, 34, S. 408–417. doi:10.1039/b315496n
- ↑ J. Muzart: "Homogeneous CrVI-Catalyzed Benzylic, Allylic and Propargylic Oxidations by tert-Butyl Hydroperoxide", in: Mini-Reviews in Organic Chemistry, 2009, (6), S. 9-20. [www.bentham.org/mroc/sample/mroc6-1/002AK.pdf Volltext]
- ↑ a b D. Nematollahi, N. Akaberi: "Electrochemical Study of Bromide in the Presence of 1,3-Indandione. Application to the Electrochemical Synthesis of Bromo Derivatives of 1,3-Indandione", in: Molecules, 2001, 6, S. 639–646. Volltext
- ↑ S. A. Galton, M. Kalafer, F. M. Beringer: "Rearrangements in the Clemmensen reduction of 1-indanones and, 1,3-indandiones", in: J. Org. Chem., 1970, 35(1), S. 1–6. doi:10.1021/jo00826a001
- ↑ O. K. Popova, Z. N. Parnes, M. I. Katinkin, S. M. Markosyan, N. I. Kopteva, L. P. Zalukaev, D. N. Kursanov: "Ionic hydrogenation of 1,3-indanedione derivatives", in: Russian Chemical Bulletin, 1981, 30(9), S. 1709–1711. doi:10.1007/BF00949478
- ↑ J. F. Neumer: "2,3-Disubstituted 1-Indanones", United States Patent 3992450. Volltext
- ↑ S. M. Resnick, D. S. Torock, K. Lee, J. M. Brand, D. T. Gibson: "Regiospecific and Stereoselective Hydroxylation of 1-Indanone and 2-Indanone by Naphthalene Dioxygenase and Toluene Dioxygenase" in Applied and Environmental Microbiology, 1994, 60(9), S. 3323–3328. Volltext
- ↑ Thomas A. Unger: "Pesticide Synthesis Handbook", Verlag William Andrew, 1996. ISBN 978-0-8155-1401-5. S. 900 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ J. L. Hallman: "Synthesis of Naphtho(f)ninhydrin and Synthesis of Polymer-supported Crown Ethers". Dissertation, 1991.Volltext
Wikimedia Foundation.