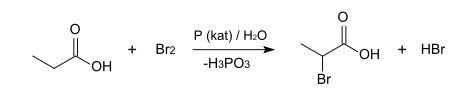
- Brompropansäuren
-
Brompropionsäuren Name 2-Brompropionsäure 3-Brompropionsäure Andere Namen 2-Brompropansäure
α-Brompropansäure3-Brompropansäure
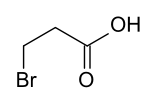
β-BrompropansäureStrukturformel 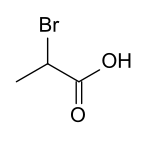
CAS-Nummer 10009-70-8 (R)-(+)-Enantiomer
32644-15-8 (S)-(−)-Enantiomer
598-72-1 (Racemat)590-92-1 PubChem 11729 11553 Summenformel C3H5O2Br Molare Masse 152,98 g·mol−1 Aggregatzustand flüssig (Enantiomere)
fest bei 20 °C (Racemat)fest Schmelzpunkt −0,5 °C (Enantiomere)[1]
25–26 °C (Racemat)[1][2]61–63 °C[3] Siedepunkt 203 °C[2] 140–142 °C (45 mm Hg)[4] Flammpunkt 100 °C[5] 65 °C[2] pKs-Wert 2,97 (18 °C)[6] Dichte 1,7 g/cm3 (25°C)[7] 1,48 g/cm3[3] Dampfdruck 0,133 hPa (25°C)[7] Löslichkeit löslich in Wasser[2][3] Brechungsindex 1,475 (20 °C, 589 nm)[7] GHS-
Einstufung
[5][4]
Gefahr
Gefahr

H- und P-Sätze 314-302 301-314 keine EUH-Sätze keine EUH-Sätze 260-301+330+331-303+361+353
305+351+338-405-501260-301+310-303+361+353
305+351+338-405-501Gefahrstoff-
kennzeichnung
Ätzend (C) R-Sätze 22-34[5][4] S-Sätze 20-26-28-36/37/39-45[5][4] LD50 323 mg·kg−1 (oral, Ratte)[7] 1451 mg·kg−1 (oral, Ratte)[4] Brompropansäuren sind aliphatische Carbonsäuren mit drei Kohlenstoffatomen, bei denen eines der an einem Kohlenstoffatom gebundenen Wasserstoffatome durch ein Bromatom ersetzt ist. Sie sind damit Derivate der Propionsäure.
Inhaltsverzeichnis
Darstellung und Gewinnung
2-Brompropionsäure kann durch die Hell-Volhard-Zelinsky-Reaktion aus Propionsäure, Brom und rotem Phosphor dargestellt werden. Dabei wird das Racemat erhalten.
Eigenschaften
Beide Brompropionsäuren sind bei Raumtemperatur feste, farblose, stechend riechende, wasserlösliche Substanzen. Die Säurestärke liegt wegen des −I-Effekts der Halogenatome über der der Stammverbindung Propionsäure. 2-Brompropionsäure ist optisch aktiv, da sie am zweiten C-Atom ein Chiralitätszentrum besitzt. Die Enantiomeren schmelzen bei −0,5 °C, wobei auch eine metastabile polymorphe Form mit einem Schmelzpunkt bei −10 °C beobachtet wurde.[1] Das Racemat liegt folgend aus dem hohen Schmelzpunkt bei 25,7 °C[1] als racemische Verbindung vor. Auch hier wurde eine metastabile polymorphe Form mit einem Schmelzpunkt bei −3,9 °C beobachtet.[1] Die racemische Mischung der beiden Enantiomeren sollte einen Schmelzpunkt um −20 °C besitzen.[1]
Verwendung
Beide isomeren Brompropionsäuren werden als Ausgangsstoffe für die Herstellung von Pharmazeutika und Pestiziden verwendet.[2] Außerdem dienen sie als Alkylierungsmittel für Mercaptane und andere schwefelhaltige Verbindungen.[2] Aus 2-Brompropionsäure kann durch Fischer-Synthese Alanin hergestellt werden.
Toxikologie
3-Brompropionsäure zeigte im Tierversuch tumorerzeugende Wirkung.[4]
Einzelnachweise
- ↑ a b c d e f L. Ramberg: Zur Kenntnis der α–Brompropionsäuren, in: Justus Liebigs Ann. Chem., 1909, 370, S. 234–239; doi:10.1002/jlac.19093700112.
- ↑ a b c d e f Datenblatt 2-Brompropionsäure bei www.chemicalland21.com
- ↑ a b c Datenblatt 3-Brompropionsäure bei www.chemicalland21.com.
- ↑ a b c d e f g Datenblatt 3-Brompropionsäure bei AlfaAesar, abgerufen am 15. August 2010 (JavaScript erforderlich).
- ↑ a b c d e Datenblatt 2-Brompropionsäure bei AlfaAesar, abgerufen am 15. August 2010 (JavaScript erforderlich).
- ↑ Brompropansäuren bei ChemIDplus.
- ↑ a b c d Datenblatt 2-Brompropionsäure bei Merck, abgerufen am 15. August 2010.
Wikimedia Foundation.