- 2-Nitroresorcin
-
Strukturformel 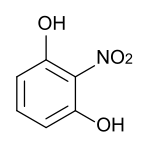
Allgemeines Name 2-Nitroresorcin Andere Namen - 2-Nitro-1,3-dihydroxybenzol
- 2-Nitro-1,3-benzendiol
Summenformel C6H5NO4 CAS-Nummer 601-89-8 PubChem 11760 Kurzbeschreibung orangefarbenes kristallines Pulver[1]
Eigenschaften Molare Masse 155,11 g·mol−1 Aggregatzustand fest
Schmelzpunkt Siedepunkt 234 °C[3]
Löslichkeit gering löslich[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302-312-315-319-332-335 EUH: keine EUH-Sätze P: 261-280-305+351+338 [2] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22-36/37/38 S: 26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2-Nitroresorcin ist ein orangefarbener Feststoff, der sowohl zur Stoffgruppe der Phenole, als auch zur Stoffgruppe der Nitroaromaten gehört.
Inhaltsverzeichnis
Darstellung
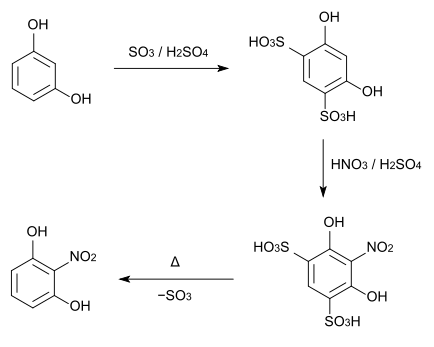
2-Nitroresorcin kann aus Resorcin hergestellt werden, das zunächst an den Positionen 4 und 6 sulfoniert wird. Diese Sulfonsäure wird dann mit Salpetersäure und Schwefelsäure nitriert. Abschließend werden die Sulfonsäuregruppen verkocht.[4][5]
Eigenschaften
Physikalische Eigenschaften
2-Nitroresorcin kristallisiert im triklinen Kristallsystem mit den Gitterparametern a = 708,3 pm, b = 769,6 pm, c = 660,7 pm, α = 74,61°, β = 77,81°, γ = 68,64°, sowie 2 Formeleinheiten pro Elementarzelle.[6] Die Selbstentzündung von 2-Nitroresorcin findet bei 426–427 °C statt.[2][7] Das Dipolmoment von 2-Nitroresorcin wurde in Dioxan zu μ = 2,9, in Benzol zu μ = 2,25 und in Tetrachlorkohlenstoff zu μ = 2,45 bestimmt.[8] 2-Nitroresorcin bildet von beiden Hydroxylgruppen zu den Sauerstoffatomen der Nitrogruppe Wasserstoffbrückenbindungen.[9][10]
Chemische Eigenschaften
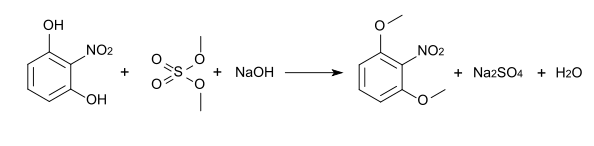
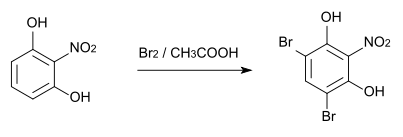
Die Methylierung von 2-Nitroresorcin mit Dimethylsulfat führt zu 2-Nitro-1,3-dimethoxybenzol[11], das einen Schmelzpunkt von 129–133 °C[12] und eine Dichte von 1,152 g/cm3[11] hat und unter der CAS-Nummer 6665-97-0 registriert ist.[12] Die Bromierung dieses Ethers mit elementarem Brom in Eisessig führt zunächst zum 4-Brom-2-nitro-1,3-dimethoxybenzol, schließlich dann zum 4,6-Dibrom-2-nitro-1,3-dimethoxybenzol.[5][13]
Bei der Bromierung von 2-Nitroresorcin mit elementarem Brom in Eisessig entsteht das 2-Nitro-4,6-dibromresorcin, dessen Schmelzpunkt bei 124 °C liegt.[14]
Verwendung
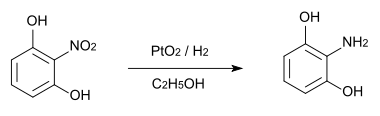
2-Nitroresorcin ist das Ausgangsprodukt zur Herstellung von 2-Aminoresorcin, das als α-Glucosidase-Inhibitor eingesetzt wird.[15] Bei dieser Synthese wird das 2-Nitroresorcin durch Wasserstoff, katalysiert durch Platindioxid zur Aminoverbindung reduziert.[16]
Das erste Kontrastmittel in der Magnetresonanztomographie 'DOPTA-Gd' wurde aus 2-Nitroresorcin hergestellt.[14]
2-Nitroresorcin wird auch als Katalysator bei der Herstellung von Bleistyphnat verwendet.[17]
Einzelnachweise
- ↑ a b c Datenblatt 2-Nitroresorcin bei AlfaAesar, abgerufen am 15. Juli 2010 (JavaScript erforderlich).
- ↑ a b c d Datenblatt 2-Nitroresorcinol bei Sigma-Aldrich, abgerufen am 20. März 2011.
- ↑ Datenblatt 2-Nitroresorcin bei ChemicalBook, abgerufen am 19. September 2011.
- ↑ Robert E. Schaffrath: "The synthesis of 2-nitroresorcinol: An experiment with sulfonic acids", in: J. Chem. Educ., 1970, 47 (3), S. 224–225; doi:10.1021/ed047p224.
- ↑ a b Hugo Kauffmann, Erwin de Pay: "Herstellung des flüchtigen Nitroresorcins", in: Ber. d. dt. chem. Ges., 1904, 37 (1), S. 725–730; Volltext.
- ↑ Charles R. Ojala, William H. Ojala, Doyle Britton: "The crystal structure of 2-nitroresorcinol", in: J. Chem. Cryst., 1996, 26 (3), S. 191–194. doi:10.1007/BF01673669
- ↑ MSDS bei www.chemcas.org
- ↑ Peter G. Hall and Gordon S. Horsfall: "Dielectric investigation of hydrogen-bonding in hydroxynitrotoluenes and nitroresorcinols", in: J. Chem. Soc., Faraday Trans. 2, 1973, 69, S. 1078–1083; doi:10.1039/F29736901078.
- ↑ V. A. Granzhan, L. M. Savenko, S. V. Semenenko and S. K. Laktionova: "Structure of nitroresorcinols", in: J. Struct. Chem., 1972, 12 (5), S. 742–748; doi:10.1007/BF00743339.
- ↑ Konstantin B. Borisenko, Istvan Hargittai: "Intramolecular hydrogen bonding and molecular structure of 2-nitroresorcinol from gas-phase electron diffraction", in: J. Phys. Chem., 1993, 97 (16), S. 4080–4084; doi:10.1021/j100118a025.
- ↑ a b M. H. Vermeulen: "Sur la structure des dinitranisols", in: Rec. Trav. Chim., 1906, 25, S. 12–31; Volltext.
- ↑ a b Eintrag bei www.lookchem.com
- ↑ "Abstracts of Papers on Organic Chemistry", Journal of the Chemical Society, 1907, 42 (1), S. 1092–1093; Volltext.
- ↑ a b Raj B. Durairaj: Resorcinol: chemistry, technology, and applications. Birkhäuser, 2005, ISBN 978-3-540-25142-2, S. 105 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ H. Gao, J. Kawabata: "2-Aminoresorcinol is a potent alpha-glucosidase inhibitor", in: Bioorg. Med. Chem. Lett., 2008, 18 (2), S. 812–815; doi:10.1016/j.bmcl.2007.11.032.
- ↑ Raj B. Durairaj: Resorcinol: chemistry, technology, and applications. Birkhäuser, 2005, ISBN 978-3-540-25142-2, S. 111 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ US Patent 3894068, "Manufacture of basic lead styphnate", Volltext bei www.freepatentsonline.com.
Wikimedia Foundation.