- Claisen-Umlagerung
-
Die Claisen-Umlagerung ist eine Reaktion aus dem Bereich der Organischen Chemie und nach Ludwig Claisen benannt. Sie stellt eine [3,3]-sigmatrope Umlagerung von Allyl-Vinylethern zu γ,δ-ungesättigten Carbonylverbindungen dar. Ein anderer Name für die Reaktion ist Oxa-Cope-Umlagerung. In verschiedenen Lehrbüchern finden sich verschiedene Aussagen darüber, ob zuerst Phenyl- oder Vinylallylether untersucht wurden.
Inhaltsverzeichnis
Bedeutung
Die Reaktion besitzt für den Synthesechemiker sehr interessante Eigenschaften. Man erhält zusammen mit gleichzeitiger Verlängerung der Kohlenstoffkette die für weitere Synthesen interessanten Carbonylverbindungen. Außerdem erhält man, ausgehend von enantiomerenreinen Ausgangstoffen, Produkte mit hohem Enantiomerenüberschuss.
Mechanismus
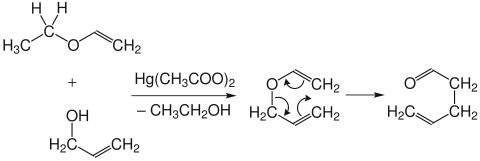
Die Claisen-Umlagerung ist prinzipiell reversibel, das Gleichgewicht liegt aber wegen der größeren thermodynamischen Stabilität der Carbonylverbindungen auf der Produktseite. Die Allylvinylether werden durch Quecksilber- oder säurekatalysierte Umsetzung der Ethylvinylether mit Allylalkohol dargestellt. Da die Allylvinylether bereits während der Synthese teilweise umlagern, werden sie in der Regel nicht isoliert.
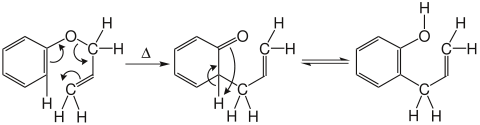
Erhitzt man Allylphenylether auf 200°C, entsteht gemäß untenstehendem Mechanismus zuerst das zu erwartende Keton, welches dann unter Rearomatisierung und Protonentransfer analog zu einer Keto-Enol-Tautomerie in das entsprechende ortho-Allylphenol umlagert.
Durch den kinetischen Isotopeneffekt wurde herausgefunden, dass die O-Cα-Bindung bereits zu 50 bis 60% gelöst während die Cortho-Cγ-Bindung erst zu 10 bis 20% gebildet ist. Das bedeutet, dass die Claisen-Umlagerung zwar eine konzertierte, aber asynchrone Umlagerung ist.
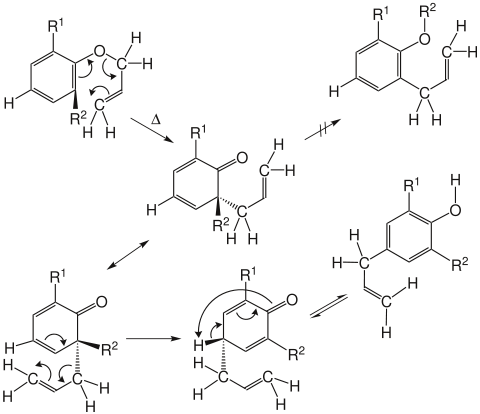
Sind die beiden ortho-Positionen durch Substituenten besetzt, erfolgt durch eine zweite [3,3]-sigmatrope Umlagerung (in diesem Fall eine Cope-Umlagerung) die Bildung des entsprechenden para-Produktes.
Varianten
Aufgrund dieser Vorzüge wurden zahlreiche Varianten entwickelt. Im Folgenden sind fünf bekanntere Varianten der Claisen-Umlagerung dargestellt.
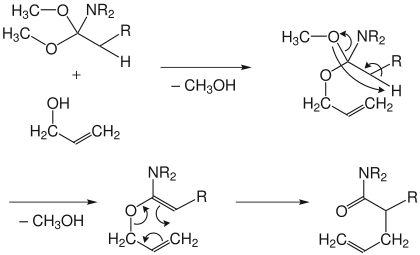
Johnson-Variante
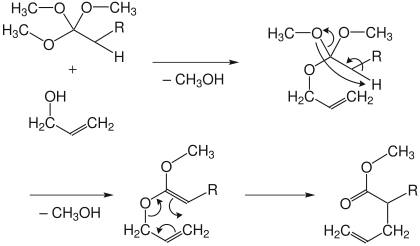
Bei der Orthoester- oder Johnson-Variante wird ein Carbonsäureorthoester unter Säurekatalyse mit dem Allylalkohol umgesetzt. Dabei werden nacheinander zwei Moleküle Methanol abgespalten. Im Anschluss erfolgt die Umlagerung zum ungesättigten Ester.
Eschenmoser-Variante
Bei der Eschenmoser-Variante wird ein Dimethylacetal eines Carbonsäureamids verwendet. Dieses reagiert mit dem Allylalkohol unter Abspaltung eines Moleküls Methanol und Bildung eines gemischten Acetals. Das Acetal eliminiert ein weiteres Molekül Methanol. Dann erfolgt die Umlagerung zu einem ungesättigten Amid.
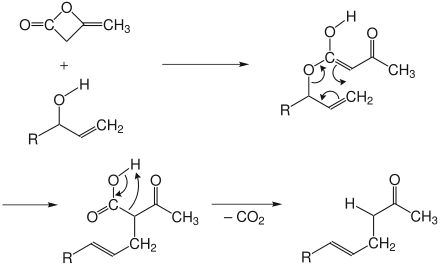
Carroll-Variante
Bei der Carroll-Variante wird der Allylalkohol zuerst mit Diketen umgesetzt. Dabei entsteht primär eine β-Ketosäure, welche zum ungesättigten Keton decarboxyliert.
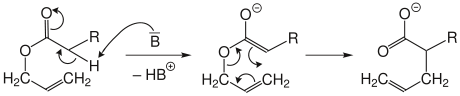
Arnold-Variante
Bei der Arnold-Variante wird ein Allylester durch starke Basen (B) deprotoniert. Das entstehende Ester-Enolat lagert dann zum Salz der ungesättigten Carbonsäure um.
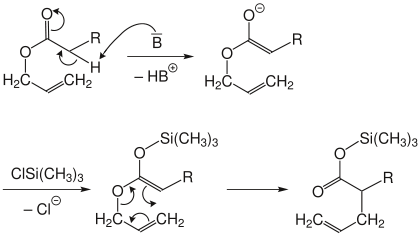
Ireland-Variante
Bei der Ireland-Variante wird zuerst, wie auch bei der Arnold-Variante, der Allylester deprotoniert. Dann wird aber der Trimethylsilyl-ether des Ester-Enolates erzeugt. Dieser lagert unter besonders milden Bedingungen um. Der Silylester kann besonders schonend gespalten werden.
Literatur
- L. Claisen, Chem. Ber. 1912, 45, 3157.
- F.A. Carey, R.J. Sundberg, Organische Chemie,1063ff, VCH 1995, ISBN 3-527-29217-9.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie; S. Hirzel Verlag, Stuttgart - Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4.
Weblinks
Wikimedia Foundation.