- Kalomelelektrode
-
Eine Elektrode [elɛkˈtroːde] (von agr. ηλεκτρόν elektron, „Bernstein“ i.ü.S „elektrisch“ und agr. ὁδός hodós, „Weg“) ist ein Elektronenleiter, der im Zusammenspiel mit einer Gegenelektrode mit einem zwischen beiden Elektroden befindlichen Medium in Wechselwirkung steht. Die meisten Elektroden bestehen aus Metall oder aus Graphit. Oft dienen sie vor allem der Stromzuführung, sie können aber auch an chemischen Reaktionen teilnehmen, z. B. löst sich die Zinkelektrode einer Batterie bei Stromfluss auf, indem Zinkionen in Lösung gehen.
Inhaltsverzeichnis
Polarität
Für die elektrochemischen Elektroden gilt: Die Elektrode, an der die Oxidation abläuft, ist die Anode. Die Elektrode, an der die Reduktion abläuft, ist die Kathode.
Welche der beiden Elektroden Plus- und welche Minuspol ist, hängt von der elektrochemischen Vorrichtung ab:
- Wenn die chemische Reaktion durch einen von einer äußeren Spannung hervorgerufenen Stromfluss erzwungen wird (Elektrolyse, Galvanisierung), wird die Oxidation durch den Elektronenentzug an der positiv geladenen Anode hervorgerufen: Die Anode ist in diesem Fall der Pluspol (+).
- Wenn die elektrische Spannung durch die chemischen Vorgänge von sich aus erzeugt wird, wie zum Beispiel bei Galvanischen Zellen (Batterie oder Brennstoffzelle), ist die Anode negativ geladen, da bei der freiwillig ablaufenden Oxidation Elektronen frei werden. Die Anode ist dann der Minuspol (-).
Auf jeden Fall aber gilt: Anode = Elektronensammler, hier findet eine Oxidation statt
Kathode = Elektronenspender, hier findet eine Reduktion stattDa sich bei einer Elektrolyse im Vergleich zu einem galvanischen Element die Polarität der Elektroden umkehrt, ist die Zuordnung von Anode und Kathode oft verwirrend. Am einfachsten ist es, sich an der Flussrichtung der Elektronen zu orientieren. Dazu stelle man sich die Zelle schematisiert vor: Die Vorsilbe ana- bedeutet aufwärts, die Vorsilbe kata- bedeutet abwärts. In der Regel ist die Anode in Zeichnungen links dargestellt, die Kathode rechts.
Elektroden im Gas oder Vakuum oder mit Isolator
Je nach Art des die Elektrode umgebenden Mediums kommt es zu unterschiedlichen Formen der Wechselwirkung:
Ist das Medium ein Isolator, baut sich zwischen den Elektroden ein elektrisches Feld auf. Diese Konfiguration wird Kondensator genannt.
Ist das Medium ein Vakuum oder ein Gas, so baut sich wie im Falle des Isolators ein elektrisches Feld zwischen den Elektroden auf. Jedoch können sich Elektronen von einer Elektrode (Kathode) zur anderen bewegen, wenn der Austritt aus der Kathode ermöglicht wird, z. B. durch Feldemission oder thermische Emission (→Elektronenröhre, Röntgenröhre). Ist das Medium ein Gas, dann werden die Atome bzw. Moleküle des Gases teilweise ionisiert, so dass ein Plasma entsteht. Im Plasma bewegen sich neben den Elektronen auch die Ionen im elektrischen Feld (→Gasentladungslampe).
Auch die Elektroden der Zündkerzen und die Schweißelektroden beim Elektroschweißen fallen in diese Kategorie. Die Schweißelektroden erzeugen beim Schweißen einen Lichtbogen mit dem zu schweißenden Material. In der Hitze des Lichtbogens schmelzen beide und die Elektrode dient als Zusatzwerkstoff, damit die Materialien verbunden werden.
Elektrochemische Elektroden
Hier ist das Medium, das an die Elektrode grenzt, ein flüssiger oder fester Ionenleiter, der Elektrolyt. Durch Oxidations- und Reduktionsreaktionen oder durch eine äußere Spannung baut sich an der Elektrode ein elektrochemisches Potenzial auf.
Man unterscheidet je nach Art der Abhängigkeit des Potenzials von der Konzentration des Elektrolyten vier Typen von Elektroden:
- Elektroden erster Art
- Elektroden zweiter Art, bei denen Feststoffe an der Reaktion beteiligt sind
- Redox-Elektroden; hier treten keine Metallionen sondern Elektronen durch die Phasengrenzen. Das Metall selbst wird dabei nicht angegriffen, da kein Stofftransport durch die Phasengrenzen stattfindet.
- Ionenselektive Elektroden, bei denen das Potenzial im Idealfall von der Konzentration nur eines bestimmten Ions abhängt.
Schließt man zwei Elektroden, die in unterschiedlich konzentrierte Elektrolytlösungen tauchen oder aus unterschiedlichen Materialien bestehen, über einen Stromkreis aneinander, erhält man ein galvanisches Element. Zwischen den Elektroden ist eine Spannung messbar, die aus der Potenzialdifferenz resultiert und die die elektromotorische Kraft (EMK) oder "reversible Zellspannung" genannt wird. Solch eine Anordnung kann Strom abgeben (Batterie). Durch Zuschalten einer äußeren Spannung laufen andere chemische Reaktionen an den Elektroden ab (Elektrolyse). Die Elektroden können aus Metallen oder Halbleitern bestehen, z. B. auch aus Graphit, Glaskohlenstoff, und können flüssig (Quecksilber) oder fest sein.
Eine zum Korrosionsschutz verwendete Elektrode ist die Opferanode.
In der Brennstoffzelle, bei Gassensoren sowie bei einigen Batterien kommt die Gasdiffusionselektrode zum Einsatz
Elektroden erster Art
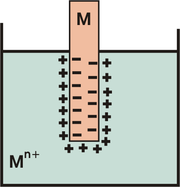
Elektroden erster Art sind Elektroden, deren Potential direkt von der Konzentration der sie umgebenden Elektrolytlösung abhängt. Dies sind beispielsweise alle Metalle, die in eine Lösung ihrer Metallionen (Elektrolytlösung) eintauchen. An der Phasengrenze kommt es zur Ausbildung eines Gleichgewichtes zwischen dem Lösungsdruck des Metalles und dem osmotischen Druck der Elektrolytlösung.
- Der Lösungsdruck des Metalles kommt dadurch zustande, dass jedes Metall versucht, aus seinem Gitter Kationen zu lösen. Durch den Überschuss an Elektronen im Metall lädt das Metall sich negativ auf. In Folge der Coulomb-Anziehung bleiben die Kationen in relativer Nähe zur Elektrode. Es bildet sich eine elektrochemische Doppelschicht aus. Das Vermögen eines Metalles, Kationen aus seinem Gitter zu entlassen, wurde für jedes Metall in der elektrochemischen Spannungsreihe aufgelistet. Je niedriger es steht, desto unedler ist es und desto höher ist damit auch sein Vermögen, Kationen zu entlassen.
- Die gegenläufige Tendenz kommt durch den osmotischen Druck der Elektrolytlösung zustande oder einfacher ausgedrückt: Elektrolytlösungen möchten sich verdünnen. Dies erreichen sie, indem sie die gelösten Metallionen in das Gitter der Elektrode drängen und dort einbauen. Dies gelingt ihnen besonders gut, wenn viele Metallionen gelöst vorliegen. Es kommt so zur Ausbildung einer elektrochemischen Doppelschicht mit umgekehrten Vorzeichen.
Auf welcher Seite (Lösungsdruck vs. osmotischer Druck) das Gleichgewicht liegt, hängt also einerseits von der Stellung des Metalles in der elektrochemischen Spannungsreihe und andererseits von der Konzentration der Elektrolytlösung ab.
Elektroden zweiter Art
Elektroden zweiter Art sind Elektroden, deren Potential nur indirekt von der Konzentration der sie umgebenden Elektrolytlösung abhängt. Die Abweichung zur Elektrode erster Art ist jedoch nur eine konstante Spannungsdifferenz (z. B. 0,230 V für eine Silber/Silberchlorid-Elektrode). Durch Subtraktion dieser Spannungswerte vom Messwert erhält man das tatsächliche Potential, bzw. die EMK einer Lösung.
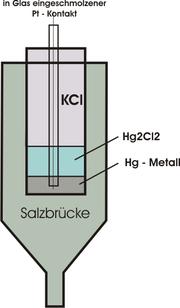
Prinzip (am Beispiel der Kalomel-Elektrode (GKE) / engl. Saturated Calomel Electrode (SCE))
Die Konzentrationsunabhängigkeit des Potentials wird durch den besonderen Aufbau der Elektrode erreicht. Genauer gesagt wird durch die besondere Zusammensetzung der Elektrolytlösung das Potential konstant gehalten. Die Elektrolytlösung besteht:
- zum einen aus einer gesättigten Lösung eines schwerlöslichen Salzes, welches als Kation aus dem gleichen Metall wie die Elektrode besteht. Beispielsweise würde man für eine Quecksilberelektrode das schwerlösliche Kalomel (Hg2Cl2) verwenden;
- und zum anderen aus einem gut löslichen und genau konzentrierten Alkalisalz, welches das gleiche Anion wie das schwerlösliche Salz enthält. Beispielsweise würde man, wenn man Kalomel als schwerlösliches Salz einsetzt, ein Alkalimetallchlorid z. B. Kaliumchlorid (KCl) verwenden.
Das Potential der Elektrode wird durch die Nernst-Gleichung beschrieben: (bei 25 °C bzw. 298,15 K)
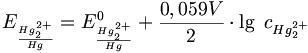
Man sieht, dass das Potential E von der Konzentration des Kations des schwerlöslichen Salzes, nämlich
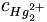 abhängt. Diese Konzentration ist wiederum über das Löslichkeitsprodukt des Kalomels mit der Konzentration des Anions gekoppelt. Wird die Konzentration des Anions konstant gehalten, bleibt folglich auch das Potential konstant. Diese Anionenkonzentration lässt sich nahezu konstant halten, indem deren Konzentration sehr groß gewählt wird (bei Silber-Silberchlorid-Elektroden oft 3 M).
abhängt. Diese Konzentration ist wiederum über das Löslichkeitsprodukt des Kalomels mit der Konzentration des Anions gekoppelt. Wird die Konzentration des Anions konstant gehalten, bleibt folglich auch das Potential konstant. Diese Anionenkonzentration lässt sich nahezu konstant halten, indem deren Konzentration sehr groß gewählt wird (bei Silber-Silberchlorid-Elektroden oft 3 M).Anwendung
Elektroden zweiter Art werden häufig in der Potentiometrie eingesetzt.
Historisches
Die Begriffe Elektrode, Elektrolyt, Anode und Kathode stammen von Michael Faraday (1791-1867).
Siehe auch
Literatur
- International Electrotechnic Vocabulary (IEV), herausgegeben von der Internationalen Elektrotechnischen Kommission (IEC)
Weblinks
Wikimedia Foundation.