- Aquaporine
-
Aquaporine Bänderdarstellung des AQP1 Bezeichner Gen-Namen MIP, AQP1, AQP2, AQP3 Transporter-Klassifikation TCDB 1.A.8 Bezeichnung MIP/Aquaporin-Familie Vorkommen Übergeordnetes Taxon Lebewesen Aquaporine (AQP) sind Proteine, die Kanäle in der Zellmembran bilden, um den Durchtritt von Wasser und einigen weiteren Molekülen zu erleichtern (Membrantransport). Sie werden daher auch Wasserkanäle genannt. Aquaporine kommen in allen Lebewesen mit Zellmembran vor; sie wurden in Archaeen, Bakterien und Eukaryoten gefunden.
Da Biomembranen in ihrem Inneren wasserabweisend (hydrophob) sind, ist ihre Leitfähigkeit für Wassermoleküle sehr gering. Die Wasserleitfähigkeit eines Aquaporinkanals beträgt dagegen bis zu 3 Milliarden Moleküle pro Sekunde. Die Proteinfamilie der Aquaporin wird in so genannte gewöhnliche Aquaporine und Aquaglyceroporine unterteilt. Gewöhnliche Aquaporine sind reine Wasserkanäle. Aquaglyceroporine leiten zusätzlich kleine Organische Moleküle wie Glycerin oder Harnstoff. Unter physiologischen Bedingungen treten Aquaporine als Tetramer auf, d.h. vier Aquaporinkanäle sind als eine Einheit in eine biologische Membran eingebaut.
Inhaltsverzeichnis
Geschichtliches
Die Tatsache, dass Wasser über Zellmembranen ausgetauscht werden kann, ist schon lange bekannt. Die ersten Mutmaßungen und Diskussionen über den Mechanismus reichen in die Mitte des 19. Jahrhunderts zurück (u. a. Ernst Wilhelm Brücke war daran beteiligt). Nach der Entdeckung der Doppellipidschicht in Plasmamembranen in den späten 1920er Jahren ging man von der einfachen Diffusion von Wasser durch die Zellmembran aus, konnte aber nicht die stark unterschiedlichen Permeabilitäten verschiedener Zellen erklären. In den 1970er Jahren wurde u. a. von Arthur Solomon, Robert Macey und Alan Finkelstein aufgrund biophysikalischer Modelle die Existenz von spezifischen Wasserkanälen postuliert. Das Problem der Identifikation ist recht komplex: Wasser ist überall vorhanden und es lässt sich nicht durch photosensible Seitenketten modifizieren. Auch Versuche einer genetischen Klonierung der entsprechenden Proteine führte nicht zum Erfolg.
Erst Anfang der 1990er Jahre gelang es der Arbeitsgruppe um Peter Agre, ein schon aus früheren Untersuchungen an Rhesus-Blutgruppenantigenen bekanntes Protein (CHIP28) mit bis dahin unbekannter Funktion als den gesuchten Wasserkanal zu identifizieren. Sie nannten dieses Protein dann Aquaporin-1 (AQP1). 2003 erhielt er für seine Forschungen auf dem Gebiet der Aquaporine den Nobelpreis für Chemie.[1] Bis heute sind eine ganze Reihe von Aquaporinen beim Menschen, bei Tieren, Pflanzen und Bakterien identifiziert worden.
Struktur
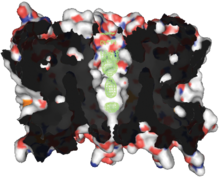
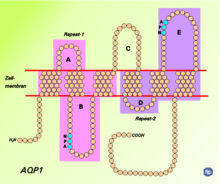
Alle bekannten Aquaporine weisen eine ähnliche Struktur und Aminosäuresequenz auf. Die Primärstruktur von AQP1 besteht aus 268 Aminosäuren.[2] Diese bilden sechs α-Helices, welche die Membran durchspannen (integrales Membranprotein). Miteinander verbunden sind die Helices über die Schleifen (Loops) A bis E. Eine besondere Rolle spielen die Loops B und E, welche jeweils eine kurze Helix bilden, die von beiden Seiten bis zur Mitte in die Membran eintauchen. Auf jedem der beiden Loops, am Ende der beiden kurzen Helices, befindet sich ein charakteristisches Strukturmotiv, bestehend aus drei Aminosäuren (N–P–A, Asparagin–Prolin–Alanin), welches wesentlich zur Selektivität des Wasserkanals beiträgt. Jeder der beiden Loops bildet eine Halbpore, die zusammen einen Wasserkanal ergeben (Hour-Glass-Model, Sanduhrmodell). Der Kanal ist in der Mitte am engsten (0,3 nm), an den beiden Öffnungen beträgt der Durchmesser 2 nm. Die carboxy- und aminoterminalen Enden des Membranproteins liegen im Zellinneren. In biologischen Membranen bilden Aquaporine Homotetramere, das heißt, dass sich vier einzelfunktionelle Porenproteine aneinanderlagern.
Funktion
Wasser kann nur in begrenztem Maße durch die Doppellipidschicht der Zellmembran diffundieren. Zellen mit sehr hoher Wasserpermeabilität, wie die renalen Tubuluszellen, sezernierende Zellen der Speicheldrüsen oder Erythrozyten benötigen für den raschen Wasseraustausch die Hilfe von Wasserkanälen. Der Unterschied zwischen Diffusion und kanalvermittelter Permeabilität ist erheblich. Diffusion ist ein Prozess, der mit geringer Kapazität in beide Richtungen durch die Membran aller Zellen abläuft. Beim Vorhandensein von spezifischen Wasserkanälen kann das Wasser fast ungehindert in Richtung des osmotischen Gradienten wandern. Die Aquaporine sind keine Pumpen oder Austauscher und zum Transport wird keine Energie verbraucht. Der Kanal arbeitet bidirektional, d. h. Wasser kann in beiden Richtungen durch den Kanal wandern. Während die Diffusion nicht blockiert werden kann, können Quecksilberverbindungen die Kanäle verschließen.
Protonenblockade
Aquaporine sind hochgradig selektiv. Insbesondere verhindern sie die Leitung von Protonen über die Membran, damit der für jede Zelle lebenswichtige Protonengradient nicht zerstört wird. (Der Protonengradient wird genutzt, um Transportvorgänge zu ermöglichen – siehe z. B. ATPasen). Dies ist nicht selbstverständlich, da Wasser in der flüssigen Phase nicht als Einzelmolekül vorliegt, sondern als ein über Wasserstoffbrückenbindungen zusammenhängendes Netzwerk. Entlang dieser Wasserstoffbrücken können Protonen von Molekül zu Molekül hüpfen (Grotthuss-Mechanismus).
Wie das Hüpfen der Protonen durch den Kanal verhindert wird, ist Gegenstand aktueller Forschung. Von Bedeutung scheint zu sein, dass Aquaporine aufgrund ihrer Struktur eine elektrostatische Barriere in der Mitte des Kanals bilden. Dies hat zur Folge, dass die polaren Wassermoleküle mit ihrem partial negativ geladen Sauerstoff meist in Richtung der Kanalmitte orientiert sind, während die partial positiv geladenen Wasserstoffe meist zu den Kanalausgängen orientiert sind. Frühe Arbeiten (2002) vermuteten daher, dass durch die Orientierung der Wassermoleküle der Grotthuss-Mechanismus unterbrochen wird.
Neuere Arbeiten bezweifeln diese Interpretation und stellen die energetische Barriere, die das Proton entlang des Kanals überwinden muss, in den Vordergrund. Gegenstand der aktuellen Debatte (Stand Juli 2007) ist der Ursprung der energetischen Barriere. Während einige Wissenschaftler die vom Protein erzeugte elektrostatische Barriere in den Vordergrund rücken, heben andere hervor, dass das Protein die Solvatationshülle eines Protons/Hydroniumions in Wasser nicht ersetzen kann.
Inhibition
Aquaporin-1 wird von Quecksilber-, Gold- oder Silberionen inhibiert (gehemmt). Dabei bindet das Ion an ein Cystein im Poreneingang und blockiert damit den Wasserfluss. Diese Ionen binden nicht spezifisch an Aquaporin-1 und sind daher toxisch. Die Suche nach spezifischen Aquaporininhibitoren ist Gegenstand aktueller Forschung.
Bedeutung
Von physiologischer Bedeutung sind die Aquaporine vor allem in Geweben, in denen ein hoher physiologischer Fluss vorkommt, z. B. beim Aufbau des Turgordrucks in Pflanzenzellen.[3]
- Bei Säugern regulieren die Aquaporine den Wasserhaushalt der roten Blutkörperchen (Erythrozyten) und der Zellen in Niere, Augenlinse, Gehirn, und Schnecke des Innenohres.
- Bei Lebergallengängen und Gallenblase sind Aquaporine für die Konzentration und Sekretion der Gallenflüssigkeit zuständig.
- Im Zentralnervensystem enthalten Zellen, die die Hirn-Rückenmarksflüssigkeit abgeben, Wasserkanäle. Sie spielen eine wichtige Rolle bei der Blut-Hirn-Schranke und treten dort in Form orthogonaler Zusammenschlüsse auf, die OAP's (orthogonal arrays of particles) genannt werden.
- In den Zellen der Blutkapillaren regeln sie Ein- und Austritt der extrazellulären Flüssigkeit.
- In den Lungenbläschen sorgen sie für den zum Gasaustausch notwendigen Flüssigkeitsfilm.
Fehlfunktionen der Aquaporine sind für Krankheiten wie Diabetes insipidus renalis, Grauer Star, Glaukom (Grüner Star) und Gehörverlust verantwortlich. Außerdem spielen Aquaporine beim Auftreten eines Hirnödems nach einem Schädel-Hirn-Trauma eine Rolle.
Nomenklatur
- Wenn Aquaporine einfach durchnummeriert sind (AQP1, AQP4) bedeutet dies, dass es sich um tierische Organismen handelt. Normalerweise wird noch der entsprechende lateinische Gattungsname vorangestellt, zum Beispiel bovAQP1 (lat. bos, bovis = Rind).
- Pflanzenaquaporine werden anders benannt. So bedeutet AtTIP2;1, dass es sich um ein tonoplast intrinsic protein der (Modell-)Pflanze Acker-Schmalwand (Arabidopsis thaliana) handelt.
Varianten
CHIPs (engl. channel-forming integral proteins) befinden sich in der Zellmembran von Roten Blutkörperchen und Nierenzellen. In Säugern ist die Dichte von Aquaporinen besonders hoch in Erythrocyten (ca. 200.000 Kanäle pro Zelle) sowie in den proximalen Tubuluszellen der Niere, die das Wasser bei der Harnbildung resorbieren.
AQP2, das in Zellen der Sammelrohre der Niere vorkommt (daher auch die alte Bezeichnung WCHDs von engl. water channels of colleng duct) wird in Vesikeln gespeichert. Bei Wassermangel wird von der Hypophyse das Hormon Vasopressin ausgeschüttet. Vasopressin bindet an bestimmte Membranrezeptoren AQP2-haltiger Zellen und setzt eine Signalkaskade in Gang. Dieses veranlasst die Vesikel, mit der Zellmembran zu verschmelzen, wodurch die Resorption von Wasser aus dem Primärharn um das Zwanzigfache gesteigert wird.
TIPs (engl. tonoplast intrisic proteins) sind bei Pflanzen in die Membran der Vakuole integriert und sorgen während des Zellwachstums für die Volumenzunahme der Zelle durch Wasseraufnahme.
PIPs (engl. plasma membrane intrinsic proteins) sind ebenfalls nur bei Pflanzen zu finden und regulieren die Wasserleitung durch die Zellen. Auf diese Weise besteht neben den Wasserleitgefäßen des Xylems ein zweites Wassertransportsystem durch die übrigen Pflanzengewebe.
Nobelpreis
Roderick MacKinnon (Rockefeller-Universität, New York) und Peter Agre (Johns-Hopkins-University, Baltimore) erhielten 2003 den Nobelpreis für Chemie für ihre Forschungen an Aquaporinen und Kalium-Kanälen.
Einzelnachweise
- ↑ Informationen der Nobelstiftung zur Preisverleihung 2003 an Peter Agre (englisch)
- ↑ UniProt P29972
- ↑ Verkman AS. (2002): Aquaporin water channels and endothelial cell function. In: J. Anat. 200(6):617-627. PMID 12162729
Weblinks
Wikimedia Foundation.