- Naphthalin
-
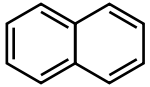
Strukturformel _ _  _
_
Allgemeines Name Naphthalin Andere Namen Naphthalen (IUPAC)
Summenformel C10H8 CAS-Nummer 91-20-3 PubChem 931 Kurzbeschreibung farbloser Feststoff[1]
Eigenschaften Molare Masse 128,173 g·mol–1 Aggregatzustand fest
Dichte 1,14 g·cm−3[1]
Schmelzpunkt Siedepunkt 218 °C[1]
Dampfdruck Löslichkeit sehr schlecht in Wasser (32 mg/l bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 


Achtung
H- und P-Sätze H: 351-302-410 EUH: keine EUH-Sätze P: 273-281-308+313 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-40-50/53 S: (2)-36/37-46-60-61 MAK aufgehoben, da Verdacht auf krebserzeugende Wirkung [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Naphthalin (von griechisch naphtha = Erdöl, korrekter Name nach IUPAC: Naphthalen) ist ein farbloser Feststoff mit der Summenformel C10H8, der schon bei Raumtemperatur sublimiert. Es ist ein bicyclischer aromatischer Kohlenwasserstoff mit charakteristischem Geruch nach Teer. Naphthalin ist gesundheitsschädlich und umweltgefährlich.
Inhaltsverzeichnis
Geschichte
1819 wurde Naphthalin vom britischen Chemiker Alexander Garden aus Steinkohleteer isoliert. 1866 wurde von Emil Erlenmeyer zum ersten Mal die Naphthalinformel aufgestellt. Traditionell wird Naphthalin auch zu den polyzyklischen aromatischen Kohlenwasserstoffen (PAK) gezählt. Das Naphthalinmolekül besteht aus zwei anellierten Benzolringen, sein chemisches Verhalten ähnelt dem der anderen PAKs.
Eigenschaften
In Wasser ist Naphthalin weitgehend unlöslich, bei Raumtemperatur lösen sich nur 0,03 g Naphthalin in einem Liter Wasser. In kurzkettigen Alkoholen ist es schlecht, in unpolaren Lösungsmitteln wie Benzol (1.130 g/l), Kohlenstoffsulfid, Ether, Toluol (910 g/l), Xylol (783 g/l), und Chloroform dagegen gut löslich. Naphthalin bildet weiße Kristallblättchen aus, die bei 80 °C zu einer farblosen Flüssigkeit schmelzen, welche bei 218 °C siedet. Wie man an dem charakteristischen, intensiv aromatischen teerähnlichen Geruch erkennt, sublimiert Naphthalin schon bei Raumtemperatur merklich. Die Geruchsschwelle liegt je nach Person bei 0,14 bis 125 mg/m³. Naphthalin hat einen brennenden Geschmack. Die Dämpfe sind brennbar, der Flammpunkt liegt bei 79,8 °C und die Zündtemperatur bei 540 °C. Die Dichte beträgt 1,15 g/cm3, daher sinkt Naphthalin in Wasser.
Reaktionsverhalten
Naphthalin verbrennt mit leuchtender, rußender Flamme. Es reagiert heftig mit Oxidationsmitteln wie Chromtrioxid und Stickstoffoxiden. Das chemische Verhalten weist große Ähnlichkeit mit dem von Benzol auf, jedoch ist es aufgrund der Molekülstruktur reaktiver als Benzol, aber weniger reaktiv als tricyclische Aromaten, wie beispielsweise Anthracen. Das Naphthalinmolekül weist 10 π-Elektronen auf. Es geht wie Benzol elektrophile Substitutionsreaktionen ein. Azulen, auch ein aromatischer Kohlenwasserstoff, ist ein Isomer des Naphthalins, es besteht aus einem Fünfer- und einem Siebener-Kohlenstoffring, aufgrund einer dipolaren Struktur ist es jedoch tiefblau und deutlich reaktiver als Naphthalin. Naphthalin kann unter gemäßigten Bedingungen zu Tetralin (C10H12) hydriert werden. Die weitere Hydrierung unter drastischeren Bedingungen führt zum Decalin (C10H18).
Die Salze des Naphthalins sind orange- oder mennigrot, das Ion von Naphthalin wird Naphthylrest genannt und hat die Summenformel C10H7. Mit konzentrierter Salpetersäure bildet Naphthalin je nach den gewählten Reaktionsbedingungen 1-Nitronaphthalin oder 2-Nitronaphthalin.
Nachweis
Die Oxidation mit Chromaten und Permanganaten oder großtechnisch mit Sauerstoff an einem Katalysator ergibt Phthalsäure. Naphthalin kann UV-spektroskopisch oder per High Performance Liquid Chromatography-Verfahren nachgewiesen werden. Spuren von Naphthalin werden per GC/MS detektiert.
Vorkommen in der Natur
Spuren von Naphthalin werden von Magnolien und einigen Hirscharten produziert. Außerdem wurde der Stoff bei einer Termitenart nachgewiesen, die es offenbar als Abwehrstoff gegen natürliche Feinde wie Ameisen und giftige Pilze verwendet.
Gewinnung und Verwendung
Naphthalin wird aus der Mittelölfraktion des Steinkohlenteers (bis zu 11 %), sowie Braunkohlen- und Holzteer, Crackgasöl oder auch aus Kohle, wenn diese verkokt wird, gewonnen. Im Steinkohleteer ist es mengenmäßig die größte Komponente. Es kommt auch in Petroleum und anderen fossilen Energieträgern vor und entsteht auch bei der Verbrennung von Holz oder Tabak. Naphthalin wird von Gaswerksstandorten und Holzimprägnierwerken emittiert, des Weiteren entsteht es auch auf Mülldeponien.
Früher war Naphthalin der Hauptbestandteil von Mottenkugeln, wird aber heute wegen seines unangenehmen Geruchs oft durch andere Substanzen ersetzt. Des Weiteren ist, wie man heute weiß, Naphthalin kaum insektizid wirksam. Auch zur Desinfektion von Insektensammlungen ist es kaum wirksam, obwohl man es lange Zeit dazu verwendete.[3] Es sind sogar Fälle bekannt, dass Insekten das Fressen von Naphthalin unbeschadet überstanden haben sollen. Naphthalin kam auch in dem Anfang des 20. Jahrhunderts verwendeten Leuchtgas vor und verstopfte oft die Gasleitungen, da es sich als Feststoff abschied. Trotz seines gesundheitlichen Gefährdungspotenzials wurde es zum Beispiel medizinisch zur Darmdesinfektion verwendet.
Hauptsächlich wird Naphthalin zur Synthese von Phthalsäureanhydrid benötigt, das zu Lösungsmitteln, Kunststoffen und Kraftstoffen weiterverarbeitet wird. Auch zur Herstellung der Lösemittel und Kraftstoffzusätze Decalin und Tetralin wird es benötigt, für die Herstellung von Azofarbstoffen, zur Synthese des Holzschutzmittels Chlornaphthalin, von Insektiziden (Carbamaten) sowie von PVC-Weichmacher-Zwischenprodukten. Außerdem zur Herstellung von Alkylnapththalinsulfaten, die als Seifen benutzt werden. Weitere industriell wichtige Abkömmlinge sind die Naphthole, Bromnaphthaline, Naphthylamine und Nitronaphthaline.
1987 wurde ungefähr eine Million Tonnen Naphthalin produziert. Westeuropa ist mit 250.000 Tonnen der Hauptproduzent von Naphthalin, dann folgen Osteuropa (200.000 Tonnen), Japan (200.000 Tonnen) und die USA (125.000 Tonnen).
Gefahren für den Metabolismus
Die letale Dosis (oral) liegt für den Menschen bei 5 g. Naphthalin führt auf der Haut zu starken Reizungen und zur Dermatitis. Naphthalin kann die roten Blutzellen schädigen. Beim Einatmen kann es zu Schleimhautreizungen, Kopfschmerzen und Übelkeit, Erbrechen und Verwirrtheitszuständen führen. Bei Einnahme führt es zu Magen-Darm-Störungen, Atemlähmung, Krämpfen und Tremor. Es ist trotz seiner geringen Löslichkeit in Wasser wassergefährdend (WGK 2). Eine Schädigung der Augenhornhaut, der Leber und Nieren ist möglich. Zwischen einem Luftvolumenanteil von 0,9 bis 5,9 Prozent bildet es explosive Gemische. Eine krebserregende Wirkung wird vermutet.
In den Mikrosomen der menschlichen Leberzellen wird Naphthalin von Cytochrom P450 metabolisiert. Die Oxidation führt über die kurzlebige Epoxid-Zwischenstufe zu den primären Metaboliten:
- trans-1,2-Dihydro-1,2-Naphthalindiol („Dihydrodiol“)
- 1-Naphthol und
- 2-Naphthol
Der Cytochrom Untertyp CYP1A2 erzeugt dabei vor allem das Dihydrodiol und 1-Naphthol, während der Untertyp CYP3A4 im Wesentlichen 2-Naphthol produziert. Als sekundäre Metaboliten entstehen aus 2-Naphthol direkt 2,6- und 1,7-Dihydroxynaphthalin. Dagegen werden Dihydrodiol und 1-Naphthol nicht weiter in den Mikrosomen abgebaut.
Derivate
Name Summenformel Molmasse [g/mol] Smp. [°C] Sdp. [°C] Dichte [g/cm³] Brechzahl 1-Naphthoesäure C11H8O2 172,18 157 300 1-Naphthoesäurechlorid C11H7ClO 190,63 16–19 190 (35 Torr) 1,265 1,6552 1-Naphthol C10H8O 144,17 94–96 278 2-Naphthalinthiol C10H8S 160,24 79–81 286 1-Naphthaldehyd C11H8O 156,18 1–2 160 (15 Torr) 1-Nitronaphthalin C10H7NO2 173,17 53–57 340 1,22 1-Fluornaphthalin C10H7F 146,16 -19 °C 215 °C 1,323 1,593 1-Chlornaphthalin C10H7Cl 162,62 -20 °C 111–113 °C (5 Torr) 1,194 1,632 2-Chlornaphthalin C10H7Cl 162,62 59,5 °C 256 °C 1,138 1-Bromnaphthalin C10H7Br 207,07 -2 279 1,489 1,670 Naphthalin-2-carbonsäure-tert-butylester C15H16O2 228,29 82-83 Naphthalin-2-thiocarbonsäure-O-ethylester C13H12OS 216,30 35–36 Naphthalin-1,3-bis(dithiocarbonsäuremethylester C14H12S4 308,51 81–82 Naphthalin-2-dithiocarbonsäuremethylester C12H10S2 218,33 52–54 Siehe auch
 Commons: Naphtalene – Album mit Bildern und/oder Videos und Audiodateien
Commons: Naphtalene – Album mit Bildern und/oder Videos und AudiodateienQuellen und Literatur
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 91-20-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15.01.2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 91-20-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Gerfried Deschka, Die Desinfektion kleiner Insektensammlungen nach neueren Gesichtspunkten, Eigenverlag Steyrer Entomologenrunde, Steyr 1987
- Roger Gläser:Alkylierung von Naphthalin mit Alkoholen an mikro- und mesoporösen Molekularsiebkatalysatoren in gasförmiger und überkritischer Reaktionsphase. Shaker Verlag (30. November 1997), ISBN 3-8265-3094-2
- BUA – Stoffberichte 39. Naphthalin. Wiley/VCH, Weinh. (1989) ISBN 3-527-28066-9
- Harald Derner:Untersuchungen über den Resonanz-Ramaneffekt an Anthracen, Naphthalin und p-nitro-p-dimethylamino-azobenzol. ISBN 3-8107-2217-0
- Karsten Strey:Neue Naphthalincarbonsäureester. Kovac Verlag 1996, ISBN 3-86064-452-1
- Cho TM, Rose RL, Hodgson E.:In vitro metabolism of naphthalene by human liver microsomal cytochrome P450 enzymes, Drug Metab Dispos, 2006 Jan;34(1):176–83.
Weblinks
Kategorien:- Stoff mit Verdacht auf krebserzeugende Wirkung
- Gesundheitsschädlicher Stoff
- Umweltgefährlicher Stoff
- Naphthalin
- Aromastoff
Wikimedia Foundation.
