- Narrengold
-
Pyrit Handstück mit ineinander verwachsenen Kristallen, 11 cm lang Chemische Formel FeS2 Mineralklasse Sulfide
II/D.17-30 (nach Strunz)
2.12.1.1 (nach Dana)Kristallsystem kubisch Kristallklasse disdodekaedrisch, 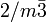 [1]
[1]Farbe kupfer- bis goldgelb Strichfarbe grün- bis bläulichschwarz Mohshärte 6 bis 6,5 [2] Dichte (g/cm³) 4,95 bis 5,2 Glanz metallisch Transparenz undurchsichtig Bruch muschelig, spröde Spaltbarkeit {001} undeutlich Habitus würfelig, z.T. oktaedrisch und pentagondodekaedrisch Häufige Kristallflächen Zwillingsbildung Durchdringunszwillinge, Zwillingsachse [001] Weitere Eigenschaften Schmelzpunkt 742 °C Chemisches Verhalten Pyrit-Pulver löslich in Salpetersäure Radioaktivität nicht radioaktiv Magnetismus magnetisch durch Erhitzen Besondere Kennzeichen Streifung auf Würfelflächen Pyrit (auch Schwefelkies oder chemisch Eisen(II)-disulfid) ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der Sulfide mit dem Stoffmengenverhältnis Metall : Schwefel (Selen, Tellur) < 1 : 1. Es kristallisiert im kubischen Kristallsystem mit der chemischen Zusammensetzung FeS2 und entwickelt überwiegend idiomorphe Kristalle (Kristalle mit vollständiger Ausbildung der Eigengestalt) in der Form von Würfeln oder Pentagondodekaedern. Auch Oktaeder und Disdodekaeder sind verbreitet, sowie Kombinationen zwischen diesen Formen.
Pyrit ist polymorph zu Markasit.
Inhaltsverzeichnis
Besondere Eigenschaften
Sein metallischer Glanz und seine goldene Farbe brachten dem Pyrit den volkstümlichen Namen Katzengold ein, was sich von dem Wort „Ketzer“ ableitet. Im englischen Sprachraum wird es fool's gold genannt, also „Narrengold“. Pyrit wird auch im Deutschen als Narrengold bezeichnet, allerdings weitaus seltener. Möglicherweise wurde der Begriff aus dem Englischen übernommen.
Anders als echtes Gold ist Pyrit aber nicht formbar und wesentlich härter als das Edelmetall. Allerdings kann Pyrit an einigen Fundstätten tatsächlich winzige Mengen Gold enthalten, die es zu einem wirtschaftlich abbaubaren Golderz machen können. [3]
Pyrit ist ein natürlicher Halbleiter, dessen Energielücke zwischen Valenzband und Leitungsband durch Einbau von Fremdatomen herabgesetzt ist. Eine Dotierung mit Arsen führt zu einem p-Halbleiter [4] Die Bandlücke liegt zwischen 0,8 und 1,8 eV. Ob es sich dabei um direkte oder indirekte Bandkantenübergänge handelt, ist noch unklar. Für den indirekten Übergang wird meist eine Energie von 0,95 eV angegeben.[2]
Aufgrund ihrer halbleitenden Eigenschaft wurden natürliche Pyrit-Stücke früher in Detektorempfängern als Kristalldetektor zur Demodulation verwendet. Durch Kontaktierung von Hand nach dem Prinzip einer Spitzendiode suchte man mit einer Nadel eine als Diode geeignete Region auf dem Stein.
Die Dielektrizitätskonstante
 von Pyrit beträgt 20,8.[2]
von Pyrit beträgt 20,8.[2]Etymologie und Geschichte
Der Name Pyrit stammt aus dem griechischen πυρ pyr für Feuer. Mit einem harten Feuerstein lassen sich Pyrit-Splitter abschlagen, die sich entzünden und verbrennen:
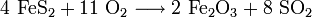 Diese Eigenschaft wurde früher genutzt, um Zunder zu entzünden und so Feuer zu machen.
Diese Eigenschaft wurde früher genutzt, um Zunder zu entzünden und so Feuer zu machen.Bildung und Fundorte
Pyrit ist bei weitem das meistverbreitete Sulfidmineral; er ist Bestandteil der meisten Sulfidlagerstätten und Beimineral der meisten mafischen Gesteine. Auch in Hydrothermaladern, wo es durch Kristallisierung eisensulfidhaltiger Lösungen entstehen kann, findet es sich. Die Weichteile von Tieren werden in stagnierenden sauerstofffreien schlammigen Milieus oft durch Pyrit ersetzt, so dass Pyrit auch in Sedimentgesteinen auftritt. Schwefelreduzierende Bakterien sind hier für die Ablagerung kleinster Kristalle verantwortlich, die sich dann bei Verdichtung der Ablagerungen zu Gestein wandeln. Bei stärkerer Komprimierung kann Pyrit zu größeren Kristallen wachsen und sogar Muschelschalen oder Knochen ersetzen. Auf diese Weise können Fossilien komplett umgewandelt werden. Ein Beispiel hierfür sind die als Goldschnecken bezeichneten Ammoniten des Jura der Fränkischen Alb. Unter Sauerstoffeinfluss an der Erdoberfläche verwittert Pyrit über mehrere Zwischenstufen zu Eisenoxidhydrat (Limonit oder Brauneisenerz) FeO.OH.
Schließlich kommt Pyrit auch in Braun- und Steinkohle sowie in sauerstofffreien Grundwasserleitern vor. Es ist in dieser Umgebung meist schlecht kristallisiert und sehr oxidationsempfindlich.
Weltweit gibt es viele Vorkommen von großen Pyritmassen („Kieskörper“). Gut kristallisierten Pyrit gibt es u.a. auf der Insel Elba, in Peru und vor allem in der Mine Victoria bei Navajun in Spanien. Berühmtheit besitzen die Pyrit-Zwillingskristalle („Eisernes Kreuz“) aus dem Weserbergland, der Umgebung von Vlotho und im Extertal.
Bis 1992 lag eine der wichtigsten großbetrieblich ausgebeuteten Vorkommen in Deutschland bei Meggen im Sauerland.
Struktur
Kristallographische Daten[5] 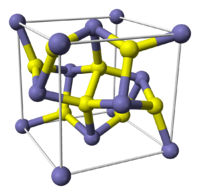
Elementarzelle von PyritKristallsystem kubisch Raumgruppe 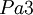
Gitterparameter
(Elementarzelle)a = 5,417 Å Zahl (Z) der
FormeleinheitenZ = 4 Pyrit kristallisiert in der kubisch-disdodekaedrischen Kristallklasse in der Raumgruppe Pa3 mit dem Gitterparameter a = 5,417 Å sowie vier Formeleinheiten pro Elementarzelle.
Strukturell ähnelt der Pyrit sehr stark dem Halit (auch Natriumchlorid, NaCl), wobei allerdings die einfach positiv geladenen Natriumionen durch Eisenionen und die einfach negativ geladenen Chlorionen durch hantelförmige S2-Gruppen, ein Disulfid-Ion, das strukturell dem Peroxid-Ion entspricht, ersetzt sind. Die Hantelachsen sind jeweils parallel zu den 3-zähligen Drehachsen ausgerichtet, jedoch in unterschiedlicher Orientierung, was zu einer Erniedrigung der Symmetrie führt. Innerhalb der "Schwefelhantel" herrscht Atombindung, zwischen Schwefel und Eisen dagegen Metallbindung. [3]
Verwendung
Wirtschaftlich wurde Pyrit zur Gewinnung von Schwefelsäure abgebaut, gelegentlich auch zur Eisengewinnung. Der bei der Schwefelsäuregewinnung übrigbleibende Rückstand, das sogenannte Purpurerz (Fe2O3) oder auch Kiesabbrand, wird in Hochöfen zu Eisen verarbeitet. Des Weiteren findet Kiesabbrand auch als Poliermittel und Farbengrundstoff Verwendung. [3]
Bei Kupferanteilen über 0,5 Prozent wird auch Kupfer gewonnen. Die Goldgewinnung lohnt sich allerdings nur bei örtlicher Anreicherung.
Im Jahr 1999 wurden in Europa nur noch ca. 3 Mio. Tonnen Pyrit zur Schwefelsäuregewinnung geröstet, der größere Anteil Schwefelsäure wird inzwischen aus der Entschwefelung fossiler Brennstoffe und anderer Abgase erhalten[6]
Bedeutung für die Umwelt
Der in Braunkohle und Steinkohle enthaltene Pyrit und andere Schwefelverbindungen geben im Verbrennungsprozess den enthaltenen Schwefel als Schwefeldioxid (SO2) an die Rauchgase ab. Wenn dieses Gas in die Atmosphäre gelangt, bildet sich in Wassertröpfchen schweflige Säure, die wesentlich zum Entstehen des „sauren Regens“ beiträgt. Durch Maßnahmen der Rauchgasentschwefelung kann das Schwefeldioxid heute weitgehend zurückgehalten werden.
Auch der in grundwasserführenden Schichten enthaltene Pyrit kann in Gegenwart von Sauerstoff oxidiert werden. Diese Oxidation ist weit überwiegend durch Bakterien katalysiert. Eine große Bedeutung hat die Oxidation des Pyrits durch denitrifizierende, eisen- und schwefeloxidierende Bakterien mit Nitrat als mittelbares Oxidationsmittel. Dies ist ein aus mehreren abiotischen und bakteriellen Redoxreaktionen bestehender Prozess, bei dem letztlich der Sulfidschwefel des Pyrits zu Sulfat (SO42-) oxidiert wird und Nitrat zu elementarem, molekularem Stickstoff (N2) reduziert wird. Man bezeichnet diesen Vorgang als „Denitrifikation“ durch Pyrit. In den Wassergewinnungsgebieten der Stadtwerke Hannover AG werden auf diese Weise jährlich größenordnungsmäßig 1000 Tonnen Pyrit umgesetzt.
Da nach der Trinkwasserverordnung der Grenzwert für Nitrat mit 50 mg/l niedriger ist als der für Sulfat mit 240 mg/l, bedeutet die Denitrifikation durch Pyrit im Hinblick auf die Einhaltung des Nitratgrenzwertes eine Entlastung. Das im Pyrit enthaltene Eisen und andere metallische Begleitelemente wie Mangan oder Nickel können teilweise in das Wasser übertreten und müssen bei der Trinkwasseraufbereitung eliminiert werden.
Esoterik
Von Esoterikern wird Pyrit als Heilstein gegen Arthritis und Ischiasschmerzen eingesetzt. Radialstrahlig gewachsener Pyrit - eine sogenannte Pyritsonne - soll als Amulett-Anhänger am Hals getragen zum einen gegen Magen- und Verdauungsstörungen wirken und zum anderen das Immunsystem stärken. [7]
Siehe auch
Einzelnachweise
- ↑ http://webmineral.com/data/Pyrite.shtml Webmineral - Pyrite] (engl.)
- ↑ a b c Oertel J, Materialchemische und elektronische Untersuchungen cobaltdotierter MOCVD-Schichten aus Pyrit für photovoltaische Anwendungen, Dissertation, FU Berlin, 2003.
- ↑ a b c Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer Verlag, Berlin, Heidelberg, New York 2005, ISBN 3-540-23812-3 (S. 38-39)
- ↑ Möller P, Hightech in der Natur – Goldanreicherung in Pyrit und Arsenopyrit, in AGF-Jahresheft, 1994, S.36
- ↑ MinDat - Pyrite (engl.)
- ↑ E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5. p. 503
- ↑ Walter Schumann: Edelsteine und Schmucksteine. 13. Auflage. BLV Verlags GmbH, 1976/1989, ISBN 3-405-16332-3, S. 282 bis 284.
Literatur
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel Verlag GmbH, Eggolsheim 2002, ISBN 3-89555-076-0
Weblinks
- Mineralienatlas:Pyrit, Mineralienatlas:Mineralienportrait/Pyrit (Wiki)
Wikimedia Foundation.




