- Parasympathikus
-
Der Parasympathikus ist eine der drei Komponenten des vegetativen Nervensystems, das für die unwillkürliche, das heißt nicht dem Willen unterliegende, Steuerung der meisten inneren Organe und des Blutkreislaufs verantwortlich ist. Er wird auch als „Ruhenerv“ bezeichnet, da er dem Stoffwechsel, der Regeneration und dem Aufbau körpereigener Reserven dient (trophotrope Wirkung). Er sorgt für Ruhe, Erholung und Schonung.
Weitgehend gegenteilige Funktionen werden vom Sympathikus gesteuert, der eine Leistungssteigerung des Organismus bewirkt und bei Angriffs- oder Fluchtverhalten und außergewöhnlichen Anstrengungen wirkt (ergotrope Wirkung). Durch ihre gegensätzliche (antagonistische) Wirkung ermöglichen diese beiden Anteile des vegetativen Nervensystems eine feine Steuerung der Organe. Das in einigen Organen vorhandene enterische Nervensystem kann als dritte Komponente des vegetativen Nervensystems angesehen werden.
Inhaltsverzeichnis
Allgemeiner Aufbau
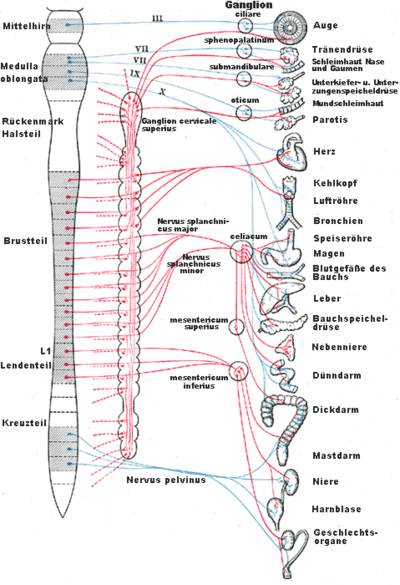
Die vegetativen Zentren des Parasympathikus liegen im Bereich des Hirnstamms (Pars cephalica, Kopfteil) und im sakralen Rückenmark (Pars sacralis, Kreuzteil). Dabei innerviert die Pars cephalica die inneren Augenmuskeln, die Tränen- und Speicheldrüsen und die vom Nervus vagus versorgten Organe. Die Pars sacralis hingegen beeinflusst den unteren Teil des Dickdarms, die Harnblase und die Genitalien. Ein ungefährer Übergang der beiden Innervationsgebiete erfolgt am Cannon-Böhm-Punkt. Aufgrund der anatomischen Lage der Wurzelzellen wird der Parasympathikus auch als kraniosakrales System (von lat. Cranium = Schädel, Os sacrum = Kreuzbein) bezeichnet, im Gegensatz zum thorakolumbalen System des Sympathikus, dessen Wurzelzellen im Brust- (lat. Thorax) und Lendenteil (lat. Lumbus) des Rückenmarks liegen.
Ganglien
In den Ganglien, welche eine Anhäufung von Nervenzellkörpern darstellen, werden die vom Zentralnervensystem kommenden Nervenfasern (präganglionäre Nerven, lat., „vor dem Ganglion liegend“) auf Nervenfasern umgeschaltet, die zum jeweiligen Erfolgsorgan ziehen (postganglionäre Nerven, lat., „auf das Ganglion folgend“). Die Ganglien liegen beim Parasympathikus – im Gegensatz zum Sympathikus – meist in der Nähe oder sogar innerhalb ihrer Zielorgane. Die Umschaltung erfolgt über chemische Synapsen durch die Übertragung von Neurotransmittern.
Neurotransmitter
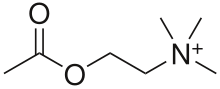
Die Überträgersubstanz (Neurotransmitter) des parasympathischen Nervensystems ist sowohl präganglionär als auch postganglionär Acetylcholin (ACh). Acetylcholin ist ein Ester der Essigsäure und des Aminoalkohols Cholin.
Die Synthese von Acetylcholin findet im präsynaptischen Terminal durch das Enzym Cholin-Acetyltransferase statt. Die Ausgangsstoffe sind Cholin und Acetyl-CoA.
Nach seiner Freisetzung in den synaptischen Spalt und Bindung an seine Rezeptoren wird Acetylcholin durch das Enzym Acetylcholinesterase zu den Endprodukten Cholin und Essigsäure (beziehungsweise Acetat) abgebaut und damit deaktiviert.
Rezeptoren
Das parasympathische Nervensystem verfügt über zwei Typen von Acetylcholinrezeptoren, also Rezeptoren, die auf Acetylcholin ansprechen. Sogenannte nikotinische Rezeptoren (nAChR, für nikotinischer Acetylcholin-Rezeptor) werden außer von Acetylcholin auch von Nikotin erregt, die muskarinischen (mAChR) auch von Muskarin, einem Gift, das in größeren Mengen in verschiedenen Trichterlingen und Risspilzen vorkommt (im Fliegenpilz wurde es entdeckt). Die nikotinischen Rezeptoren lassen sich weiter unterteilen nach ihrem Vorkommen im vegetativen Nervensystem: NM-Rezeptoren befinden sich an der motorischen Endplatte, also an der Verschaltung von Nerven mit ihren innervierten Muskeln, NN-Rezeptoren hingegen sind in den Ganglien des vegetativen Nervensystems lokalisiert. Die muskarinische Rezeptoren werden in die Subtypen M1 bis M5 unterschieden. M1 kommt in vegetativen Ganglien, M2 im Herzen und M3 in glatter Muskulatur vor, hierbei vor allem im Verdauungstrakt. Die Funktionen von M4 und M5 sind noch nicht gänzlich bekannt, sie kommen aber im Gehirn vor.
Nikotinische Rezeptoren
Die nikotinischen Rezeptoren der motorischen Endplatte und die der vegetativen Ganglien unterscheiden sich nur in ihrem Aufbau, in ihrer Funktion sind sie gleich.
Es handelt sich um Kanäle in der Zellmembran, die nach Kontakt mit Acetylcholin durchlässig für Kationen (positiv geladene Ionen wie Na+ und Ca2+) werden. Deshalb zählt man sie zur Gruppe der ionotropen Rezeptoren.
Binden zwei Acetylcholinmoleküle an den Rezeptor, so öffnet sich dieser und erzeugt damit einen Na+- und Ca2+-Einstrom (s. Diffusion). Dieser verursacht ein frühes (rasches) exzitatorisches postsynaptisches Potential, das heißt, er depolarisiert die Membran. Ist diese Depolarisation stark genug, so wird ein Aktionspotential ausgelöst.
Nikotinische Rezeptoren verdanken ihren Namen dem Umstand, dass sie auch durch Nikotin aktiviert werden können, des Weiteren auch durch Carbachol. Die NM-Rezeptoren werden durch Tubocurarin gehemmt, die NN-Rezeptoren durch Hexamethonium.
Muskarinische Rezeptoren
Die muskarinischen Rezeptoren gehören zur Gruppe der G-Protein-gekoppelten Rezeptoren. Nach der Bindung von Acetylcholin werden weitere Moleküle (so genannte Second Messenger) freigesetzt, die dann letztendlich die Veränderungen an der Zelle vornehmen. Deshalb gehören sie zur Gruppe der metabotropen Rezeptoren.
Bei den M1-, M3- und M5-Rezeptoren löst die Bindung von Acetylcholin die Aktivierung der Phospholipase Cβ (PLCβ) durch ein Gq-Protein aus. Die Phospholipase spaltet Phosphatidylinositol-4,5-bisphosphat (PIP2, ein Phospholipid) in Inositoltrisphosphat (IP3) und Diacylglycerol (DAG). Während DAG in der Zellmembran verbleibt, bewirkt IP3 eine Freisetzung von Calcium aus dem endoplasmischen Retikulum. Dieses löst entweder ein spätes EPSP oder eine Kontraktion von glatter Muskulatur im Fall der M3-Rezeptoren aus.
M2- und M4Rezeptoren hingegen aktivieren ein Gi-Protein (i für inhibitorisch, hemmend). Dieses öffnet im Sinus- und AV-Knoten des Herzens bestimmte K+-Kanäle (IKACh). Dies hat eine negativ chronotrope (pulssenkende) und dromotrope (Erhöhung der Zeit, die für die Reizweiterleitung benötigt wird) Wirkung. Zusätzlich wird das Enzym Adenylylcyclase gehemmt, dies bewirkt einen Rückgang der intrazellulären cAMP-Konzentration. Dieser Rückgang wirkt sich negativ auf den Calcium-Einstrom aus, was einen negativ inotropen (Reduzierung der Kontraktilität) Effekt auf das Herz hat.
Gehemmt werden muskarinische Rezeptoren unter anderem durch Atropin, ein Gift, das unter anderem in der Tollkirsche vorkommt.
Anatomische Struktur
Pars cephalica
Die Kerngebiete (Nuclei) der Pars cephalica liegen in den Nuclei des Nervus oculomotorius (Hirnnerv III), Nervus facialis (VII), Nervus glossopharyngeus (IX) und Nervus vagus (X).
Nervus oculomotorius
Zielorgan Wirkung Musculus sphincter pupillae Kontraktion Ziliarmuskel Kontraktion Die präganglionären Fasern des parasympathischen Anteils des Nervus oculomotorius (Augenbewegernerv) entspringen dem Nucleus accessorius nervi oculomotorii (zusätzlicher Kern des Augenbewegernervs, Edinger-Westphal-Kern) und ziehen zum Ganglion ciliare. Dort schalten sie um auf Neuronen der Nervi ciliares breves. Diese verlaufen zum Musculus sphincter pupillae („Pupillenverenger“), wo sie eine Verengung (Miosis) der Pupillen verursachen, und zum Ziliarmuskel, der die Brechkraft der Augenlinse (Akkommodation) beeinflusst.
Nervus facialis
Zielorgan Wirkung Tränendrüsen Aktivierung Glandula submandibularis Aktivierung Der parasympathische Anteil des Nervus facialis (Gesichtsnerv) entspringt im Nucleus salivatorius superior (oberer Speichelkern), in der Medulla oblongata (Nachhirn). Ein Teil dieser Fasern, der Nervus petrosus major (großer Paukennerv), verläuft zum Ganglion pterygopalatinum (Flügelgaumenganglion), wo er auf den Neuronen umgeschaltet wird, deren Fasern im Nervus lacrimalis (Tränennerv) zur Tränendrüse verlaufen, die dadurch zur Tränenproduktion angeregt werden.
Ein weiterer Teil des Nervus facialis, die Chorda tympani (Paukensaite), verläuft zum Ganglion submandibulare (Unterkieferganglion), wo es auf Neuronen umgeschaltet wird, die die Speicheldrüsen am Unterkiefer, die Glandula submandibularis (Unterkieferdrüse) und die Glandula sublingualis (Unterzungendrüse), innervieren. Sie lösen dort eine Gefäßerweiterung der versorgenden Arterien und eine gesteigerte Proteinproduktion aus und machen den Speichel damit wässrig.
Nervus glossopharyngeus
Zielorgan Wirkung Parotis Aktivierung Die präganglionären parasympathischen Fasern des Nervus glossopharyngeus (von griech. glossa=Zunge, pharynx=Rachen) entspringen dem Nucleus salivatorius inferior (unterer Speichelkern) in der Medulla oblongata. Seine Fasern verlaufen, teilweise im Nervus petrosus minor (kleiner Paukennerv) zum Ganglion oticum (Ohrganglion), wo sie auf Neuronen umgeschaltet werden, die im Nervus auriculotemporalis („Ohr-Schläfen-Nerv“) zur Glandula parotidea (Ohrspeicheldrüse) verlaufen und diese zur Speichelabsonderung anregen.
Nervus vagus
Die präganglionären parasympathischen Fasern des Nervus vagus (von lat. vagari - „umherschweifen“) entspringen dem Nucleus dorsalis nervi vagi (rückwärtiger Kern des Vagusnervs) in der Medulla oblongata. Der Nervus vagus verlässt den Schädel durch das Foramen jugulare und verläuft dann zusammen mit der Arteria carotis communis (Halsschlagader) und der Vena jugularis interna (innere Drosselvene) im Hals in Richtung Körper. Dort innerviert er das Herz, die Bronchien, den Verdauungstrakt und den Harnleiter.
Pars sacralis
Der Kreuzteil des Parasympathikus entspringt dem Nucleus intermediolateralis (äußerer Zwischenkern) und Nucleus intermediomedialis (innerer Zwischenkern) in den Rückenmarkssegmenten S2 bis S4. Sie verlaufen im Nervus pudendus (Schamnerv) und gehen von diesem als Nervi pelvici (Beckennerven) in den Plexus hypogastricus inferior (unteres Untermagengeflecht) ein. Die Umschaltung auf weitere Neuronen erfolgt entweder hier oder in kleinen Ganglien der innervierten Organe.
Die Pars sacralis innerviert den Dickdarm ab dem Cannon-Böhm-Punkt, die Harnblase und die Genitalien.
Unterer Dickdarm
Dickdarm Aktiviert die Sekretion Aktiviert den Tonus Entspannt den (inneren) Schließmuskel Der Parasympathikus hat eine anregende Wirkung auf den Dickdarm, genau wie auf den restlichen Verdauungstrakt. Die Drüsen werden zur Sekretion angeregt, der Tonus der glatten Muskulatur wird erhöht und die Schließmuskel werden entspannt.
Außerdem spielt der Parasympathikus eine Rolle beim Stuhlgang (Defäkation). Dies findet mit Hilfe eines Reflexes statt, der durch das parasympathische Nervensystem vermittelt wird. Werden freie Nervenendigungen im Rektum durch Dehnung stimuliert, so werden Signale in die Kreuzsegmente des Rückenmarks gesendet. Diese lösen im Rückenmark die Aussendung von Signalen zum Colon descendens (absteigenden Grimmdarm), Colon sigmoideum und Mastdarm aus. Diese laufen in parasympathischen Fasern des Nervus pelvicus, erhöhen die Anzahl und Stärke der peristaltischen Wellen der glatten Muskulatur in der Darmwand und entspannen den inneren Schließmuskel des Anus. Im Gegensatz zum inneren Schließmuskel, der aus glatter Muskulatur besteht, ist der äußere Schließmuskel ein Skelettmuskel und damit unter willkürlicher Kontrolle.
Harnblase
Harnblase Kontraktion des Detrusor Entspannung des Sphinkter Das Harnlassen (die Miktion) unterliegt größtenteils der Kontrolle des Parasympathikus. Er bewirkt dies, indem er die glatte Muskulatur in der Wand der Harnblase, die auch als Musculus detrusor bezeichnet wird, aktiviert. Die Kontraktion des Musculus detrusor presst die gesamte Blase zusammen.
Zusätzlich wird der innere Schließmuskel der Blase (Sphinkter) durch den Parasympathikus entspannt.
Genitalien
In den Genitalien bewirkt der Parasympathikus eine Vasodilatation (Gefäßerweiterung), die die Erektion zur Folge hat.
Wirkung des Nervus vagus auf die inneren Organe
Die parasympathische Innervation der inneren Organe erfolgt durch den Nervus vagus. Die betroffenen Organe sind Herz, Bronchien, Magen, Darm (bis auf den unteren Dickdarm, dieser wird von der Pars sacralis innerviert), Gallenblase, Leber, Pankreas und die Harnleiter.
Herz
Herz Erregungsleitung langsamer (negativ dromotrop) Erregbarkeit reduziert (negativ bathmotrop) Frequenz reduziert (negativ chronotrop) Am Herz bewirkt der Parasympathikus eine Verlangsamung des Pulses (negative Chronotropie) und der Erregbarkeit (negative Bathmotropie). Außerdem verlangsamt er die Erregungsleitung vom Sinusknoten zum AV-Knoten und im AV-Knoten selbst (negative Dromotropie).
Die Versorgungsgebiete des rechten und linken Nervus vagus überlappen sich am Herzen, wobei der rechte vorwiegend den Sinusknoten innerviert und dort die Pulsfrequenz beeinflusst, der linke hingegen hauptsächlich den AV-Knoten und damit die Erregungsleitung.[1]
Die cholinergen Rezeptoren im Herzen sind vom Typ M2. Sie aktivieren ein Gi-Protein (i für inhibitorisch, hemmend). Im Sinus- und AV-Knoten öffnet es bestimmte K+-Kanäle (IKACh). Durch den bewirkten Kaliumausstrom wird die Zelle hyperpolarisiert, das heißt ihr Membranpotential wird negativer. Dies erschwert die Auslösung eines Aktionspotentials, das zur Muskelkontraktion führt.
In den Herzmuskelzellen werden die langsamen Natriumkanäle, sogenannte „Funny-Channels“ (cAMP-abhängig), teilweise inaktiviert und so verzögert sich die spontane Depolarisation der Schrittmacherzellen (Frequenzabnahme, negativ chronotrop).
Bronchien
Bronchien Aktiviert die Sekretion Kontraktion der glatten Muskulatur In den Bronchien löst der Parasympathikus Bronchokonstriktion (Verengung der Bronchien) und eine erhöhte Schleimsekretion durch Stimulation der M3-Rezeptoren aus.
In der glatten Muskulatur der Bronchien löst der durch IP3 ausgelöste Calciumeinstrom eine Kontraktion aus, dies führt zur Verengung der Bronchien.
Die erhöhte Sekretion der schleimproduzierenden Drüsen wird durch eine erhöhte Blutzufuhr ausgelöst. Die erhöhte Blutzufuhr wird durch die Freisetzung von Stickstoffmonoxid (NO) und die dadurch bewirkte Gefäßerweiterung (Vasodilatation) verursacht.
Verdauungstrakt
Verdauungstrakt Aktiviert die Sekretion Aktiviert den Tonus Entspannt die Schließmuskeln Der Verdauungstrakt besitzt ein eigenes Nervensystem, das enterische Nervensystem, dessen Wirkung durch das vegetative Nervensystem nur modulierend beeinflusst wird.
Die parasympathische Komponente fördert dabei generell die Verdauung durch eine Erhöhung der Peristaltik und der Sekretion von Verdauungsenzymen. Im Magen und Darm wird zudem der Tonus (Spannungszustand) der glatten Muskulatur erhöht und die Sphinkter (Schließmuskeln) werden durch die Wirkung von Stickstoffmonoxid entspannt.
Die Tonuserhöhung und die erhöhte Sekretion der Drüsen basiert auf den gleichen Mechanismen wie in der Lunge.
Leber, Gallenblase und Pankreas
Leber, Gallenblase, Pankreas Leber: Glykogen-Synthese Gallenblase: Kontraktion Pankreas: Exokrine Sekretion In der Leber regt der Parasympathtikus die Glykogenbildung an.
In der Gallenblase löst er durch die Kontraktion der glatten Muskulatur in der Organwand die Leerung der enthaltenen Galle aus.
Die exokrine Sekretion der Bauchspeicheldrüse wird durch die Erhöhung der Durchblutung angeregt. Dies bewirkt die Sekretion der eiweißspaltenden Verdauungsenzyme (Trypsin, Chymotrypsin, Elastase, Carboxylpeptidase).
Harnleiter
Harnleiter Kontraktion der glatten Muskulatur Die glatte Muskulatur im Harnleiter wird durch die Innervation des Nervus vagus kontrahiert.
Klinische Bedeutung
Die Wirkung des Parasympathikus kann durch Medikamente beeinflusst werden. Die angestrebte Wirkung orientiert sich jeweils an der durch den Parasympathikus modulierten Organwirkung und deren Veränderung bei Anwendung von Medikamenten. Man unterscheidet Parasympatholytika, welche die Wirkung des Parasympathikus hemmen, und Parasympathomimetika, welche die Wirkung anregen.
Parasympatholytika
Parasympatholytische Substanzen wie Atropin wirken über eine kompetitive Hemmung des Acetylcholins. Bei Anwendung überwiegt aufgrund der Hemmung des Parasympathikus dann der Einfluss des Sympathikus.
Anwendungsgebiete sind z. B. die Pupillenerweiterung (Mydriasis) für therapeutische Maßnahmen, die Therapie von Spasmen des Magen-Darm-Traktes, der Harnwege sowie der Muskulatur der Atemwege (Bronchospasmus). Auch akute Bradykardien, d. h. der starke Abfall der Herzfrequenz, können durch Parasympatholytika behandelt werden.
Parasympathomimetika
Es gibt direkt und indirekt wirkende Parasympathomimetika. Erstere (wie Pilocarpin) wirken ähnlich dem Acetylcholin. Bei den indirekten Parasympathomimetika wie Physostigmin handelt es sich um reversible oder irreversible Cholinesterasehemmer, welche den Abbau des Acetylcholins durch die Cholinesterase hemmen und so eine längere Transmitterwirkung bedingen.
Anwendungsgebiete der Parasympathomimetika umfassen z. B. die Therapie von Glaukomen.
Literatur
- Kandel, Eric et al. (Hrsg): Neurowissenschaften, Spektrum 1995, ISBN 3-86025-391-3
- Rohen, Johannes W.: Funktionelle Neuroanatomie. Lehrbuch und Atlas. Schattauer, F.K. Verlag, 2001. ISBN 3-7945-2128-5
- Schmidt, Robert F.; Schaible, Hans-Georg (Hrsg.): Neuro- und Sinnesphysiologie. Springer, Berlin 2006 (5. Aufl.). ISBN 3-540-25700-4
- Schmidt, Robert F.; Lang, Florian; Thews, Gerhard: Physiologie des Menschen. Mit Pathophysiologie. Springer, Berlin 2004. ISBN 3-540-21882-3
Quellen
- ↑ Rubart M, Zipes DP: Anatomy of the Cardiac Conduction System in Zipes DP et al. (Hrsg.): Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine. 7. Auflage. W.B. Saunders Company; Philadelphia 2004; 653-659. ISBN 1-4160-0014-3

Dieser Artikel wurde in die Liste der lesenswerten Artikel aufgenommen.
Wikimedia Foundation.