- Liste der Häufigkeiten chemischer Elemente
-
Die Liste der Häufigkeiten chemischer Elemente gibt die relative Häufigkeit der einzelnen chemischen Elemente in verschiedenen Systemen, wie dem gesamten Universum, der Erde oder dem menschlichen Körper an. Die Häufigkeit der Elemente unterscheidet sich je nach betrachtetem System stark voneinander.
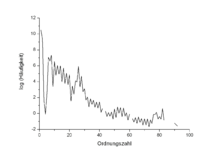
Wird das gesamte Universum betrachtet, ist der durch primordiale Nukleosynthese entstandene Wasserstoff das mit Abstand häufigste Element. Danach folgt Helium, das teilweise ebenfalls durch primordiale Nukleosynthese entstanden ist, aber auch im Zuge des Wasserstoffbrennens in Sternen entsteht. Alle weiteren Elemente zusammen machen nur einen kleinen Teil der im Universum vorhandenen Materie aus. Die Häufigkeiten folgen dabei großteils den Reaktionszyklen der stellaren Nukleosynthese. So sind die nicht direkt in Sternen gebildeten Elemente Lithium, Bor und Beryllium selten, die darauf folgenden wie Kohlenstoff und Sauerstoff häufig. Ein für ein so schweres Element häufiges ist Eisen, das den Endpunkt der stellaren Nukleosynthese darstellt. Alle schwereren Elemente können nur durch andere astrophysikalische Ereignisse wie Novae oder Supernovae gebildet werden und sind dementsprechend seltener. Charakteristisch ist auch die unterschiedliche Häufigkeit von Elementen mit gerader und ungerader Ordnungszahl, die ebenfalls mit der Nukleosynthese über Heliumkerne zusammenhängt (Harkinssche Regel)
Auf der Erde unterscheidet sich die Elementhäufigkeit von der im Weltraum. So sind die im Universum dominierenden Elemente Wasserstoff und Helium selten, da sie vorwiegend in Sternen und Gasplaneten wie etwa Jupiter zu finden sind. Stattdessen sind die häufigsten Elemente Sauerstoff, Eisen und Silicium. Es gibt auf der Erde große Unterschiede in der Verteilung. So findet sich ein Großteil des Eisens im Erdkern, während Sauerstoff und Silicium vorwiegend in der Erdkruste zu finden sind. Betrachtet man andere Systeme auf der Erde, etwa die Meere oder biologische Systeme, ändern sich die Häufigkeiten der Elemente wiederum.
Die ersten systematischen Untersuchungen zur Elementhäufigkeit stammen von Victor Moritz Goldschmidt, nach ihm heißt die grafische Darstellung der Elementhäufigkeiten Goldschmidt-Diagramm.
Inhaltsverzeichnis
Legende
- Element: Name des Elementes
- Symbol: Elementsymbol des jeweiligen Elementes
- Ordnungszahl: Ordnungszahl des jeweiligen Elementes
- Masse: Masse des jeweiligen Elementes in der Einheit u
- Häufigkeit: Häufigkeit des Elementes im betrachteten System in den angegebenen Einheiten (ppmw bezieht sich jeweils auf ein Massenverhältnis)
- Bemerkungen: Hinweise zur Elementhäufigkeit, etwa zur Verteilung oder Entstehung
- essentiell: ist das Element essentiell
Häufigkeiten im Sonnensystem
Element Symbol Ordnungszahl Masse (u) Häufigkeit (relativ zur Siliciumhäufigkeit, Si = 1 • 106 (willkürlich festgelegt))[1] Bemerkungen Wasserstoff H 1 1,008 3,18 ⋅ 1010 Häufigstes Element, entstand durch primordiale Nukleosynthese Helium He 2 4,003 2,21 ⋅ 109 Zweithäufigstes Element, entstand teilweise durch primordiale Nukleosynthese sowie durch Wasserstoffbrennen Lithium Li 3 6,941 4,95 ⋅ 101 entstand in Spuren während des Urknalls Beryllium Be 4 9,012 0,81 Bor B 5 10,811 3,50 ⋅ 102 Kohlenstoff C 6 12,011 1,18 ⋅ 107 entsteht durch den Drei-Alpha-Prozess Stickstoff N 7 14,007 3,74 ⋅ 106 Sauerstoff O 8 15,999 2,15 ⋅ 107 entsteht durch Weiterreaktion des Drei-Alpha-Prozesses Fluor F 9 18,998 2,45 ⋅ 103 Neon Ne 10 20,180 3,44 ⋅ 106 entsteht durch Kohlenstoffbrennen Natrium Na 11 22,990 6,0 ⋅ 104 Magnesium Mg 12 24,305 1,061 ⋅ 106 entsteht durch Kohlenstoff- und Neonbrennen Aluminium Al 13 26,982 8,5 ⋅ 104 Silicium Si 14 28,086 1,0 ⋅ 106 entsteht durch Sauerstoffbrennen Phosphor P 15 30,974 9,6 ⋅ 103 entsteht durch Sauerstoffbrennen Schwefel S 16 32,065 5,0 ⋅ 105 entsteht durch Sauerstoffbrennen Chlor Cl 17 35,453 5,7 ⋅ 103 Argon Ar 18 39,948 1,172 ⋅ 105 Kalium K 19 39,098 4,2 ⋅ 103 Calcium Ca 20 40,078 7,21 ⋅ 104 Scandium Sc 21 44,956 3,5 ⋅ 101 Titan Ti 22 47,867 2,775 ⋅ 103 Vanadium V 23 50,942 2,62 ⋅ 102 Chrom Cr 24 51,996 1,27 ⋅ 104 Mangan Mn 25 54,938 9,3 ⋅ 103 Eisen Fe 26 55,845 8,3 ⋅ 105 stabilster Kern, Endpunkt der Kernfusion in Sternen, entsteht durch Siliciumbrennen Cobalt Co 27 58,933 2,21 ⋅ 103 Nickel Ni 28 58,693 4,8 ⋅ 105 Kupfer Cu 29 63,546 5,4 ⋅ 102 Zink Zn 30 65,409 1,244 ⋅ 103 Gallium Ga 31 69,723 4,8 ⋅ 101 Germanium Ge 32 72,640 1,15 ⋅ 102 Arsen As 33 74,922 6,6 Selen Se 34 78,960 6,72 ⋅ 101 Brom Br 35 79,904 1,35 ⋅ 101 Krypton Kr 36 83,798 4,68 ⋅ 101 Rubidium Rb 37 85,468 5,88 Strontium Sr 38 87,620 2,69 ⋅ 101 Yttrium Y 39 88,906 4,8 Zirconium Zr 40 91,224 2,8 ⋅ 101 Niob Nb 41 92,906 1,4 Molybdän Mo 42 95,940 4,0 Technetium Tc 43 98,906 0 radioaktiv, nicht natürlich Ruthenium Ru 44 101,070 1,9 Rhodium Rh 45 102,906 0,4 Palladium Pd 46 106,420 1,3 Silber Ag 47 107,868 0,45 Cadmium Cd 48 112,411 1,48 Indium In 49 114,818 0,189 Zinn Sn 50 118,710 3,6 größte Anzahl an stabilen Isotopen Antimon Sb 51 121,760 0,316 Tellur Te 52 127,60 6,42 Iod I 53 126,904 1,09 Xenon Xe 54 131,293 5,38 Caesium Cs 55 132,905 0,387 Barium Ba 56 137,327 4,8 Lanthan La 57 138,906 0,445 Cer Ce 58 140,116 1,18 Praseodym Pr 59 140,908 0,149 Neodym Nd 60 144,240 0,78 Promethium Pm 61 146,915 0 radioaktiv Samarium Sm 62 150,360 0,226 Europium Eu 63 151,964 0,085 Gadolinium Gd 64 157,250 0,297 Terbium Tb 65 158,925 0,055 Dysprosium Dy 66 162,500 0,36 Holmium Ho 67 164,930 0,079 Erbium Er 68 167,259 0,225 Thulium Tm 69 168,934 0,034 Ytterbium Yb 70 173,040 0,216 Lutetium Lu 71 174,967 0,036 Hafnium Hf 72 178,490 0,21 Tantal Ta 73 180,948 0,021 seltenstes stabiles Element Wolfram W 74 186,840 0,16 Rhenium Re 75 186,207 0,053 Osmium Os 76 190,230 0,75 Iridium Ir 77 192,217 0,717 Platin Pt 78 195,078 1,4 Gold Au 79 196,967 0,202 Quecksilber Hg 80 200,590 0,4 Thallium Tl 81 204,383 0,192 Blei Pb 82 207,20 4,0 schwerstes stabiles Element, Endpunkt mehrerer Zerfallsreihen Bismut Bi 83 208,980 0,143 instabil, auf Grund langer Halbwertszeit noch nicht zerfallen Thorium Th 90 232,038 0,058 instabil, auf Grund langer Halbwertszeit noch nicht zerfallen Uran U 92 238,029 0,0262 instabil, auf Grund langer Halbwertszeit noch nicht zerfallen Häufigkeiten auf der Erde
Element Symbol Ordnungs-
zahlHäufigkeit gesamte Erde (ppmw)[2] Häufigkeit Erdhülle (ppmw)[3] Häufigkeit kontinentale Erdkruste (ppmw) [4] Häufigkeit Ozeane (mg/l) [4] Bemerkungen Wasserstoff H 1 8,8 ⋅ 103 1,4 ⋅ 103 1,08 ⋅ 105 überwiegend in Wasser enthalten Helium He 2 0,004 0,008 7 ⋅ 10-6 entsteht auf der Erde durch α-Zerfall, in Erdgas enthalten Lithium Li 3 2,3 6,0 ⋅ 101 2,0 ⋅ 101 0,18 Vorkommen in Mineralen wie Amblygonit und in Salzseen Beryllium Be 4 0,046 5,3 2,8 5,6 ⋅ 10-6 selten, Minerale sind bsp. Beryll und Bertrandit Bor B 5 0,26 1,6 ⋅ 101 1,0 ⋅ 101 4,44 Vorkommen in Borat-Mineralen wie Borax und Kernit Kohlenstoff C 6 1,7 ⋅ 10 3 8,7 ⋅ 102 2 ⋅ 102 2,8 ⋅ 101 kommt auch elementar als Diamant und Graphit vor, vor allem in Carbonat-Mineralen zu finden Stickstoff N 7 1,27 3 ⋅ 102 1,9 ⋅ 101 0,5 überwiegend als N2 in der Atmosphäre enthalten, selten gebunden in Mineralen wie Chilesalpeter Sauerstoff O 8 3,24 ⋅ 10 5 4,94 ⋅ 105 4,61 ⋅ 105 8,47 ⋅ 105 elementar als O2 in der Atmosphäre, große Zahl von oxidischen und silicatischen Mineralen Fluor F 9 5,12 2,8 ⋅ 102 5,85 ⋅ 102 1,3 häufigste Minerale sind Fluorit und Fluorapatit Neon Ne 10 0,005 0,005 1,2 ⋅ 10-4 seltener Bestandteil der Erdatmosphäre Natrium Na 11 1,870 ⋅ 10 3 2,64 ⋅ 104 2,36 ⋅ 104 1,08 ⋅ 104 häufiger Bestandteil des Meerwassers, viele Minerale wie Halit Magnesium Mg 12 1,58 ⋅ 10 5 1,94 ⋅ 104 2,33 ⋅ 104 1,29 ⋅ 103 vor allem in Carbonaten wie Dolomit und Silicaten wie Olivin zu finden, häufigerer Bestandteil des Meerwassers Aluminium Al 13 1,5 ⋅ 10 4 7,57 ⋅ 104 8,23 ⋅ 104 0,002 häufig, weit verbreitet in Oxiden, Hydroxiden und Alumosilicaten wie Feldspat Silicium Si 14 1,71 ⋅ 10 5 2,58 ⋅ 105 2,82 ⋅ 105 2,2 zweithäufigster Bestandteil der Erdkruste, große Zahl von Silicat-Mineralen Phosphor P 15 6,90 ⋅ 10 2 9 ⋅ 102 1,05 ⋅ 103 0,06 in Phosphaten, vor allem Apatit gebunden Schwefel S 16 4,60 ⋅ 10 3 4,8 ⋅ 102 3,5 ⋅ 102 9,05 ⋅ 102 auch elementar, dazu eine Vielzahl Sulfid- und Sulfat-Minerale Chlor Cl 17 1,0 ⋅ 101 1,9 ⋅ 103 1,45 ⋅ 102 1,94 ⋅ 104 als Chlorid, große Halit-Vorkommen, häufiger Bestandteil des Meerwassers Argon Ar 18 3,6 3,5 0,45 häufigstes Edelgas auf der Erde, Bestandteil der Atmosphäre Kalium K 19 1,71 ⋅ 10 2 2,41 ⋅ 104 2,09 ⋅ 104 3,99 ⋅ 102 wichtige Kalisalze sind Sylvin und Carnallit Calcium Ca 20 1,62 ⋅ 10 4 3,39 ⋅ 104 4,15 ⋅ 104 4,12 ⋅ 102 häufig, als Carbonat (Calcit), Silicat, Sulfat (Gips), Phosphat (Apatit) und Fluorid (Fluorit) zu finden Scandium Sc 21 1,0 ⋅ 101 5,1 2,2 ⋅ 101 6,0 ⋅ 10-7 selten, ein Scandium-Mineral ist Thortveitit Titan Ti 22 7,64 ⋅ 10 2 4,1 ⋅ 103 5,65 ⋅ 103 0,001 häufig, vor allem als Rutil und Ilmenit zu finden Vanadium V 23 9,3 ⋅ 101 4,1 ⋅ 102 1,20 ⋅ 102 0,0025 seltene Minerale sind u.a.Vanadinit und Patronit, vor allem als Beimischung in anderen Erzen
Chrom Cr 24 4,2 ⋅ 10 3 1,9 ⋅ 102 1,02 ⋅ 102 0,0003 häufigstes Mineral ist Chromit, Einzelfunde gediegenen Chroms sind bekannt Mangan Mn 25 1,39 ⋅ 10 3 8,5 ⋅ 102 9,5 ⋅ 102 0,0002 häufig in Oxiden wie Braunsteinen, Manganknollen in der Tiefsee Eisen Fe 26 2,88 ⋅ 10 5 4,7 ⋅ 104 5,6 ⋅ 104 0,002 der Erdkern besteht großteils aus Eisen, in der Erdkruste v.a. oxidische und sulfidische Minerale, selten auch gediegen Cobalt Co 27 8,00 ⋅ 10 2 3,7 ⋅ 101 2,5 ⋅ 101 2 ⋅ 10-5 gediegen in Meteoriten und Erdkern, gebunden vor allem in Sulfid- und Arsenidmineralen wie Smaltit oder Cobaltit Nickel Ni 28 1,69 ⋅ 10 4 1,5 ⋅ 102 8,4 ⋅ 101 0,00056 gediegen in Meteoriten und Erdkern, gebunden vor allem in Sulfid- und Arsenidmineralen wie Millerit oder Nickelit Kupfer Cu 29 6,5 ⋅ 10 1 1,0 ⋅ 102 6,0 ⋅ 101 0,00025 auch gediegen, sulfidische und oxidische Minerale wie Chalcopyrit und Cuprit Zink Zn 30 24 1,2 ⋅ 102 7 ⋅ 101 0,0049 Vorkommen vor allem als Sphalerit, Wurtzit und Smithsonit Gallium Ga 31 3,1 1,4 ⋅ 101 1,9 ⋅ 101 3 ⋅ 10-5 selten, vergesellschaftet mit Zink, Aluminium oder Germanium Germanium Ge 32 7,3 5,6 1,5 5 ⋅ 10-5 selten, vor allem in sulfidischen Mineralen Arsen As 33 1,1 5,5 1,8 0,0037 selten gediegen, gebunden in Arseniden, Arsenchalcogeniden wie Realgar und Arsenaten Selen Se 34 2,5 0,8 0,05 0,0002 Selenide kommen selten in sulfidischen Erzen vor Brom Br 35 0,4 6,0 2,4 6,73 ⋅ 101 als Bromid meist zusammen mit Chlorid, auch im Meerwasser und Salzseen enthalten Krypton Kr 36 1,9 ⋅ 10-5 0,0001 0,00021 seltener Bestandteil der Atmosphäre Rubidium Rb 37 0,6 2,9 ⋅ 101 9 ⋅ 101 0,12 in geringen Mengen in anderen Alkalimetallerzen enthalten Strontium Sr 38 1,37 ⋅ 101 1,4 ⋅ 102 3,7 ⋅ 102 7,9 als Sulfat (Cölestin) und Carbonat (Strontianit) zu finden Yttrium Y 39 2,4 2,6 ⋅ 101 3,3 ⋅ 101 1,3 ⋅ 10-5 vergesellschaftet mit den schwereren Lanthanoiden bsp. in Gadolinit Zirconium Zr 40 6,8 2,1 ⋅ 102 1,65 ⋅ 102 3 ⋅ 10-5 häufigstes Mineral ist Zirkon, seltener Baddeleyit Niob Nb 41 0,47 1,9 ⋅ 101 2,0 ⋅ 101 1,0 ⋅ 10-5 vergesellschaftet mit Tantal vor allem in Mineralen der Columbit- und Tapiolit-Reihe Molybdän Mo 42 1,66 1,4 ⋅ 101 1,2 0,01 häufigstes Vorkommen als Molybdänit, seltener als Wulfenit oder Powellit Technetium Tc 43 1,2 ⋅ 10-15 äußerst selten als kurzlebiges Spaltprodukt von Uran Ruthenium Ru 44 1,18 0,02 0,001 7 ⋅ 10-7 selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen Rhodium Rh 45 0,23 0,001 0,001 selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen Palladium Pd 46 0,88 0,011 0,015 sowohl gediegen als auch in Sulfiden gebunden, vergesellschaftet mit den anderen Platinmetallen Silber Ag 47 0,046 0,12 0,075 4 ⋅ 10-5 gediegen, in sulfidischen Erzen wie Argentit, selten auch als Halogenid (Chlorargyrit) Cadmium Cd 48 0,18 0,3 0,15 0,00011 vergesellschaftet mit Zinkerzen als Greenockit und Otavit Indium In 49 0,0094 0,1 0,25 0,02 selten, vergesellschaftet mit Zink Zinn Sn 50 0,39 3,5 ⋅ 101 2,3 4 ⋅ 10-6 selten gediegen, häufigstes Mineral ist Zinnstein Antimon Sb 51 0,04 0,65 0,2 0,00024 selten gediegen, gebunden in Antimoniden und Antimonchalcogeniden wie Stibnit Tellur Te 52 0,31 0,01 0,001 selten, auch elementar, sonst als Tellurid Iod I 53 0,04 0,06 0,45 0,06 als Iodid und Iodat, u.a. als Lautarit in Chilesalpeter Xenon Xe 54 9 ⋅ 10-6 3 ⋅ 10-5 5 ⋅ 10-5 seltener Bestandteil der Atmosphäre Caesium Cs 55 0,041 6,5 3,0 0,0003 in geringen Mengen in anderen Alkalimetallerzen enthalten Barium Ba 56 4,06 2,6 ⋅ 102 4,25 ⋅ 102 0,013 häufigstes Mineral ist das Sulfat Baryt, auch als Carbonat (Witherit) Lanthan La 57 0,42 1,7 ⋅ 101 3,9 ⋅ 101 3,4 ⋅ 10-6 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Cer Ce 58 1,1 4,3 ⋅ 101 6,55 ⋅ 101 1,2 ⋅ 10-6 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Praseodym Pr 59 0,17 5,2 9,2 6,4 ⋅ 10-7 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Neodym Nd 60 0,81 2,2 ⋅ 101 4,15 ⋅ 101 2,8 ⋅ 10-6 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Promethium Pm 61 1,5 ⋅ 10-15 äußerst selten als kurzlebiges Spaltprodukt Samarium Sm 62 0,26 6,0 7,5 4,5 ⋅ 10-7 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Europium Eu 63 0,098 0,099 2,0 1,3 ⋅ 10-7 vergesellschaftet mit den anderen leichten Lanthanoiden in Ceriterden wie Monazit Gadolinium Gd 64 0,35 5,9 6,2 7 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Terbium Tb 65 0,067 0,85 1,2 1,4 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Dysprosium Dy 66 0,42 4,3 5,2 9,1 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Holmium Ho 67 0,096 1,1 1,3 2,2 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Erbium Er 68 0,28 2,3 3,5 8,7 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Thulium Tm 69 0,042 0,19 0,52 1,7 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Ytterbium Yb 70 0,28 2,5 3,2 8,2 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Lutetium Lu 71 0,043 0,7 0,8 1,5 ⋅ 10-7 vergesellschaftet mit den anderen schweren Lanthanoiden in Yttererden wie Gadolinit Hafnium Hf 72 0,20 4,2 3,0 7 ⋅ 10-6 nur als Bestandteil von Zirconium-Mineralen zu finden Tantal Ta 73 0,028 8 2,0 2,0 ⋅ 10-6 vergesellschaftet mit Niob vor allem in Mineralen der Columbit- und Tapiolit-Reihe Wolfram W 74 0,17 6,4 ⋅ 101 1,25 0,0001 überwiegend als Wolframat oder Oxid, bsp. als Wolframit oder Scheelit Rhenium Re 75 0,063 0,001 0,0007 4 ⋅ 10-6 selten, vorwiegend in Molybdän-Erzen Osmium Os 76 0,82 0,01 0,0015 selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen Iridium Ir 77 0,77 0,001 0,001 selten, kommt gediegen vor, vergesellschaftet mit anderen Platinmetallen Platin Pt 78 1,56 0,005 0,005 häufigstes Platinmetall, vergesellschaftet mit den anderen Platinmetallen Gold Au 79 0,10 0,005 0,004 4 ⋅ 10-6 überwiegend gediegen, selten auch als Tellurid Quecksilber Hg 80 0,4 0,085 3 ⋅ 10-5 vorwiegend als Sulfid in Zinnober, seltener auch gediegen in Form von Tröpfchen Thallium Tl 81 0,004 0,29 0,85 1,9 ⋅ 10-5 in Mineralen wie Avicennit, vergesellschaftet mit Blei, Rubidium, Zink oder Eisen Blei Pb 82 0,67 1,8 ⋅ 101 1,4 ⋅ 101 3 ⋅ 10-5 selten gediegen, häufigstes Mineral ist Galenit Bismut Bi 83 0,016 0,2 0,0085 2 ⋅ 10-5 elementar, in Oxiden wie Bismit und Sulfiden wie Bismutin Polonium Po 84 2,1 ⋅ 10-11 2 ⋅ 10-10 1,5 ⋅ 10-14 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Astat At 85 3 ⋅ 10-21 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Radon Rn 86 6,1 ⋅ 10-11 4 ⋅ 10-13 6 ⋅ 10-16 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Francium Fr 87 1,3 ⋅ 10-18 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Radium Ra 88 9,5 ⋅ 10-11 9 ⋅ 10-7 8,9 ⋅ 10-11 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Actinium Ac 89 6,1 ⋅ 10-14 5,5 ⋅ 10-9 sehr seltenes Zwischenprodukt mehrerer Zerfallsreihen Thorium Th 90 0,051 1,1 ⋅ 101 9,6 1,0 ⋅ 10-6 radioaktiv, vergesellschaftet mit den Lanthanoiden, vor allem in Monazit Protactinium Pa 91 9 ⋅ 10-8 1,4 ⋅ 10-6 5 ⋅ 10-11 sehr seltenes Zwischenprodukt beim Zerfall von Uran Uran U 92 0,014 3,2 2,7 0,0032 radioaktiv, wichtigstes Mineral ist Uraninit Neptunium Np 93 4 ⋅ 10-14 sehr seltenes Zwischenprodukt beim Zerfall von Uran Plutonium Pu 94 2 ⋅ 10-16 geringe Mengen des langlebigsten Isotops 244Pu finden sich in manchen Uranerzen Zusammensetzung des menschlichen Körpers (ca. 70 kg)
Element Symbol Ordnungs-
zahlMasse in g [5] Stoffmenge
in molessentiell Bemerkungen Sauerstoff O 8 4,3 ⋅ 104 2,7 ⋅ 103 ja vor allem als Wasser gebunden Kohlenstoff C 6 1,60 ⋅ 104 1,3 ⋅ 103 ja Grundlage aller organischen Verbindungen des Körpers Wasserstoff H 1 7 ⋅ 10 3 6,9 ⋅ 103 ja Häufigstes Element, vor allem als Wasser gebunden Stickstoff N 7 1,8 ⋅ 10 3 1,3 ⋅ 102 ja Bestandteil aller Aminosäuren Calcium Ca 20 1,2 ⋅ 10 3 3,0 ⋅ 101 ja Knochenaufbau Phosphor P 15 7,80 ⋅ 102 2,5 ⋅ 101 ja als Phosphat; Bestandteil der DNA, Energiestoffwechsel, als Knochenbildner Hydroxylapatit Schwefel S 16 1,40 ⋅ 102 4,4 ja in den Aminosäuren Cystein und Methionin enthalten Kalium K 19 1,25 ⋅ 102 3,2 ja wichtig für das Membranpotential inner- und außerhalb der Zellen Natrium Na 11 1 ⋅ 102 4,3 ja wichtig für das Membranpotential inner- und außerhalb der Zellen Chlor Cl 17 9,5 ⋅ 101 2,7 ja Bestandteil der Magensäure, Regulation des Wasserhaushaltes Magnesium Mg 12 2,5 ⋅ 101 1,0 ja Bestandteil verschiedener Enzyme, bei Pflanzen des Chlorophylls Fluor F 9 5 2,6 ⋅ 10-1 ja als Fluorapatit im Zahnschmelz und in Knochen enthalten Eisen Fe 26 4,0 7,2 ⋅ 10-2 ja Bestandteil vieler Enzyme und des Hämoglobins Zink Zn 30 2,3 3,5 ⋅ 10-2 ja Bestandteil vieler Enzyme Silicium Si 14 1,0 3,6 ⋅ 10-2 ja in Spuren als Silicat in Knochen Titan Ti 22 0,70 1,5 ⋅ 10-2 nein keine bekannten biologischen Funktionen Rubidium Rb 37 0,68 8,0 ⋅ 10-3 nicht eindeutig wegen Ähnlichkeit zu Kalium im Körper enthalten Strontium Sr 38 0,32 3,7 ⋅ 10-3 nein wegen Ähnlichkeit zu Calcium im Körper enthalten Brom Br 35 0,26 3,3 ⋅ 10-3 nein Bromid wegen Ähnlichkeit zu Chlorid im Körper enthalten Blei Pb 82 0,12 5,8 ⋅ 10-4 nicht eindeutig giftig, kann in Knochen bei Verdrängung von Calcium gespeichert werden Kupfer Cu 29 0,07 1,1 ⋅ 10-3 ja Bestandteil verschiedener Enzyme, v. a. Oxidasen, Ähnlichkeit zu Eisen Aluminium Al 13 0,06 2,2 ⋅ 10-3 nein wegen Schwerlöslichkeit im Körper selten, Konkurrenz zu Eisen Cer Ce 58 0,04 2,9 ⋅ 10-4 nein keine bekannten biologischen Funktionen Zinn Sn 50 0,03 2,5 ⋅ 10-4 nicht eindeutig keine genaue Funktion bekannt Barium Ba 56 0,02 1,5 ⋅ 10-4 nein wegen Ähnlichkeit zu Calcium im Körper enthalten Cadmium Cd 48 0,02 1,8 ⋅ 10-4 nicht eindeutig kann teilweise Zink verdrängen Bor B 5 0,018 1,7 ⋅ 10-3 nicht eindeutig essentielles Element für manche Pflanzen Nickel Ni 28 0,015 2,6 ⋅ 10-4 ja Bestandteil von Enzymen Iod I 53 0,015 1,2 ⋅ 10-4 ja in Schilddrüsenhormonen enthalten Selen Se 34 0,014 1,8 ⋅ 10-4 ja in der Aminosäure Selenocystein enthalten Mangan Mn 25 0,012 2,2 ⋅ 10-4 ja Bestandteil verschiedener Enzyme, in Pflanzen wichtig für die Photosynthese Arsen As 33 0,007 9,3 ⋅ 10-5 nicht eindeutig biologische Bedeutung geringer Arsenmengen nicht genau bekannt, in höheren Dosen toxisch Lithium Li 3 0,007 1,0 ⋅ 10-3 nein wegen Ähnlichkeit zu Natrium im Körper enthalten Molybdän Mo 42 0,005 5,2 ⋅ 10-5 ja Bestandteil von Enzymen wie der Xanthinoxidase Chrom Cr 24 0,002 2,8 ⋅ 10-5 ja als dreiwertiges Chrom möglicherweise am Fettstoffwechsel beteiligt, als Chromat toxisch Cobalt Co 27 0,002 3,4 ⋅ 10-5 ja im Vitamin B12 enthalten Literatur
- Binder, H.: Lexikon der chemischen Elemente - Das Periodensystem in Fakten, Zahlen und Daten; Hirzel Verlag, Stuttgart/Leipzig, 1999, 856 S., ISBN 3-7776-0736-3.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
Einzelnachweise
- ↑ A. G. W. Cameron: Abundances of the elements in the solar system in: Space Science Reviews, 1970, 15, 121-146
- ↑ Claude Allègre, Gérard Manhès, Éric Lewin: Chemical composition of the Earth and the volatility control on planetary genetics. In: Earth and Planetary Science Letters, 2001, 185, 49-69-
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag 1999, ISBN 3-7776-0736-3
- ↑ a b David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 85. Auflage, CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ Wolfgang Kaim, Brigitte Schwederski: Bioanorganische Chemie, 4. Auflage, Teubner, 2005, ISBN 3-519-33505-0.

Diese Seite wurde in die Auswahl der informativen Listen und Portale aufgenommen. Kategorien:- Chemisches Element
- Liste (Chemie)
- Wikipedia:Informative Liste
Wikimedia Foundation.