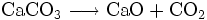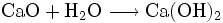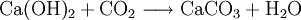- Kohlensaurer Kalk
-
Strukturformel 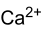
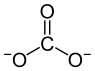
Allgemeines Name Calciumcarbonat Andere Namen - Kalziumkarbonat
- Kalk
Summenformel CaCO3 CAS-Nummer 471-34-1 ATC-Code Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 100,09 g·mol−1 Aggregatzustand fest
Dichte 2,73 g·cm−3 [1]
Schmelzpunkt 825 °C (Zersetzung)
Löslichkeit - gut löslich in Säuren
- unlöslich in org. Lösungsmitteln
- nahezu unlöslich in Wasser: 0,014 g·l−1 (20 °C)
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 6450 mg·kg−1 (Ratte)
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumcarbonat (fachsprachlich), Kalziumkarbonat oder in deutscher Trivialbezeichnung kohlensaurer Kalk, ist eine chemische Verbindung der Elemente Calcium, Kohlenstoff und Sauerstoff mit der chemischen Formel CaCO3. Es ist als Carbonat ein Calcium-Salz der Kohlensäure und besteht im festen Zustand aus einem Ionengitter mit Ca2+-Ionen und CO32−-Ionen im Verhältnis 1:1.
Inhaltsverzeichnis
Vorkommen
Calciumcarbonat ist eine der am weitesten verbreiteten Verbindungen auf der Erde, vor allem in Form von Sedimentgesteinen. Calciumcarbonat tritt vor allem in der Form der Minerale Calcit und Aragonit auf. Eine weitere Modifikation des CaCO3 ist das Mineral Vaterit, welches besonders aus übersättigten Lösungen in Form mikroskopisch kleiner Kristalle ausfällt.
Calciumcarbonat ist ein Hauptbestandteil in Marmor, Kalkstein und Dolomit, es kommt in Knochen und Zähnen sowie im Außenskelett der Krebstiere, Korallen, Muscheln, Schnecken und Einzeller vor. Die ersten Kalkgesteine nennenswerten Ausmaßes entstanden durch Stromatolithe vor über zwei Milliarden Jahren.
Eigenschaften
Calciumcarbonat selbst ist in reinem Wasser kaum löslich. Bei Anwesenheit von gelöstem Kohlenstoffdioxid steigt die Löslichkeit jedoch um mehr als das hundertfache. Auf diesem Effekt beruht die Verwitterung von Kalkgestein, wobei sich das leicht lösliche Calciumhydrogencarbonat Ca(HCO3)2 bildet. Wegen seiner Löslichkeit ist Calciumhydrogencarbonat ein Bestandteil der meisten natürlichen Gewässer, je nach Gestein in unterschiedlichen Konzentrationen. Die Konzentration von Calciumcarbonat im Wasser wird in Deutschland mit „Grad Deutsche Härte“ (1 °dH = 10 mg/Liter CaO oder 17,85 mg/Liter CaCO3) angegeben. Auch durch andere saure Bestandteile der Luft (Salpetersäure und Schwefeldioxid), sowie durch Nitrifikation im Boden, wird Calciumcarbonat gelöst. Der Umkehrung dieses Lösevorgangs, z. B. Entzug von Kohlensäure durch Temperaturerhöhung, verdanken die meisten natürlichen Vorkommen von Calciumcarbonat ihre Entstehung. Der komplizierte Mechanismus, der an manchen Wasserläufen sichtbar ist (so etwa bei den Kalkterassen in Pamukkale), wird durch das Kalk-Kohlensäure-Gleichgewicht definiert.
Modifikationen in der Natur
In der Natur bildet Calciumcarbonat verschiedene Calciumcarbonat-Gesteine, die zwar chemisch identisch sind, sich jedoch sonst in mancherlei Hinsicht unterscheiden:
 Eine der bekanntesten Marmorstatuen, der David von Michelangelo
Eine der bekanntesten Marmorstatuen, der David von Michelangelo- Kreide ist ein feines, mikrokristallines Sedimentgestein, das durch Ablagerung von durch photosynthetischen Kohlensäureentzug gefälltem Calcit sowie der aragonitischen Schalen von fossilen Kleinlebewesen, wie Coccolithen der Coccolithophoriden und Schalen der Kammerlinge (Foraminifera), entstanden ist. Kreide tritt an zahlreichen Standorten entlang des europäischen Kreidegürtels zutage, von Großbritannien über Frankreich bis hin zur Insel Rügen in Norddeutschland, und wird stellenweise abgebaut. Seekreide am Grund von Seen oder in verlandeten Seebecken besteht fast vollständig aus gefälltem Calcit. Die Tafelkreide der Technik wird dagegen vor allem aus Gips (Calciumsulfat) hergestellt.
- Kalkstein wird ebenfalls überwiegend von Lebewesen gebildet und ist stärker verfestigt als Kreide. Die Kalkablagerung geschieht entweder direkt oder indirekt aus den Überresten der Lebewesen, wie zum Beispiel von Schnecken, Muscheln, gesteinsbildenden Korallen und Schwämmen, die Calciumcarbonat zum Aufbau von Außen- oder Innenskeletten abscheiden. Indirekt wird er dadurch gebildet, dass Lebewesen, vor allem phototrophe, CO2 assimilieren und so das Milieu alkalisieren, was zur Ausfällung von Calciumcarbonat führt. Die Größe der Carbonatkristalle liegt zwischen derjenigen von Kreide und Marmor. Große Kalkstein-Vorkommen befinden sich zum Beispiel auf der Schwäbischen und Fränkischen Alb, in den Kalkalpen und den Westalpen, im Himalaya und in vielen anderen Gebieten.
- Marmor ist ein grobkristallines, metamorphes Gestein, das entsteht, wenn Kreide, Kalkstein oder Dolomit unter dem Einfluss hoher Temperaturen und / oder hoher Drücke (über 1.000 bar) umkristallisiert werden. Große Marmor-Vorkommen finden sich in Nordamerika und in Europa beispielsweise in Österreich (Gummern), Norwegen (Molde) oder im italienischen Carrara, der Heimat des reinweißen Statuario, aus dem Michelangelo seine Skulpturen schuf.
Verwendung
Natürliches Calciumcarbonat (Kalkstein) wird in großen Mengen als Rohstoff für die Baustoff-Industrie, als Zuschlagstoff in der Stahlindustrie, als mineralischer Dünger und als mineralischer Füllstoff in diversen industriellen Anwendungen (Papier, Farbe, Putz, Kunststoff, Teppiche) verwendet. Insgesamt werden jährlich über 5 Milliarden Tonnen Kalkgestein abgebaut. Der Haupteinsatz ist die Herstellung von Zement (Calciumsilikat, Calciumaluminat) und Branntkalk. Aus gebranntem Kalk wird durch Löschen mit Wasser Kalkhydrat hergestellt, der im Zement oder Wandbeschichtungen wie dem Tadelakt wiederum mit der Luft-Kohlensäure zu Calciumcarbonat carbonatisiert. Die ersten Entdecker dieses Phänomens waren die Römer, die im großen Stile Kalkbrennanlagen betrieben. Insofern kann analog zum Kohlenstoffkreislauf von einem technischen Kreislauf des Calciumcarbonats gesprochen werden (Technischer Kalkkreislauf).
Obgleich mehr als fünf Prozent der Erdkruste aus Calciumcarbonat-Gesteinen besteht, sind nur wenige Lagerstätten für die Gewinnung von Füllstoffen geeignet, die möglichst weiß sein sollen. Der größte industrielle Anwender von weißen Calciumcarbonaten ist mit einer Menge von über 10 Millionen Tonnen (weltweit) pro Jahr die Papierindustrie, danach folgt die Kunststoff- und die Baustoff-Industrie (Putze und Farben) mit insgesamt nochmals 15 Millionen Tonnen pro Jahr. Für den Einsatz in der Papierindustrie, vor allem als Streichfarbe, werden in Europa insbesondere Lagerstätten in Frankreich, Italien, Deutschland, Norwegen und Österreich abgebaut, wobei das Mineral durch Nassmahlung zerkleinert und als Slurry (teilweise per Tankschiff) in den Handel kommt. Es ist als Lebensmittelzusatzstoff und -farbstoff (E 170) zugelassen. Für andere Anwendungen wird Calciumcarbonat gebrochen und / oder gemahlen und kommt stückig oder als Mehl in den Handel. Für einige Anwendungen sind natürliche Calciumcarbonate nicht optimal, so dass hier synthetische Calciumcarbonate verwendet werden.
Synthetisches Calciumcarbonat
Synthetisches Calciumcarbonat wird als PCC (precipitated calcium carbonate, ausgefälltes Calciumcarbonat) bezeichnet (im Unterschied zu GCC = ground calcium carbonate, gemahlenes Calciumcarbonat). Mit der Bezeichnung Hydro-Calcit wird dieses Material in der Wassertechnik zur Entsäuerung von Wässern mit aggressiver Kohlensäure verwendet. Es wird durch Einleiten von Kohlensäure (Kohlenstoffdioxid) in Kalkmilch (Calciumhydroxid) gefällt und so als Präzipitat gewonnen:
Die Fällung erfolgt bei einem Feststoffgehalt von etwa 20 %. Über die Prozessführung (z. B. Temperatur, Konzentration) können unterschiedliche Kristallmodifikationen (Kristallmorphologien) erzeugt („gezüchtet“) werden, z. B. rhomboedrische oder skalenoedrische Kristallform. Weil mit hochreinen Ausgangsprodukten gearbeitet werden kann, sind die PCCs besonders weiß und haben auch Vorteile bezüglich der Opazität. Inzwischen erzeugen große Papierfabriken PCC in einem „Verbund“, indem sie Kohlenstoffdioxid, das bei der Verbrennung in Kraftwerken in Form von Rauchgasen entsteht, durch Bindung an Calciumhydroxid wieder rückgewinnen. Dies stellt jedoch keinen Beitrag zur Reduzierung der Kohlensäure-Konzentration (Klimawandel) dar, weil bei der zuvor notwendigen Herstellung von Kalkhydrat natürlicher Kalkstein gebrannt werden muss, und dabei CO2 freigesetzt wird.
Siehe auch
Quellen
- ↑ a b Eintrag zu CAS-Nr. 471-34-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. 08. 2008 (JavaScript erforderlich)
- Papierlexikon; Hrsg. Lothar Göttsching und Casimir Katz; Gernsbach 1999; ISBN 3-88640-080-8
- Wolfgang Tegethoff: Calciumcarbonat; ISBN 3-7643-6424-6
Wikimedia Foundation.