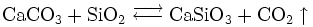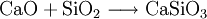- Calciumsilikat
-
Wollastonit-1T Wollastonit mit Blick auf Spaltflächen Chemische Formel CaSiO3; genauer Ca3[Si3O9] Mineralklasse Silicate, Germanate
VIII/F.18-10 (nach Strunz)
65.2.1.1a (nach Dana)Kristallsystem triklin Kristallklasse triklin-pinakoidal, 
Farbe farblos, weiß; z. T. grau, gelb, rot, braun Strichfarbe weiß Mohshärte 4,5 – 5 Dichte (g/cm³) 2,8 – 2,9 Glanz Glasglanz, Perlmuttglanz auf Spaltflächen Transparenz durchscheinend bis undurchsichtig Bruch uneben Spaltbarkeit {100} vollkommen; {001} und {102} gut
Winkel in der (010)-Ebene:
(100):(001) = 84,5°
(100):(102) = 70°Habitus massig,
Einkristalle (selten): nadelig bis faserig, selten tafeligHäufige Kristallflächen {001}, {540}, {100}, {101}, {102} Zwillingsbildung häufig, Zwillingsachse [010]
Verwachsungsebene (100)Kristalloptik Brechzahl nα = 1,616 – 1,640
nβ = 1,628 – 1,650
nγ = 1,631 – 1,653Doppelbrechung
(optische Orientierung)Δn = 0,013 – 0,014 ; zweiachsig negativ Winkel/Dispersion
der optischen Achsen2vz ~ 36 – 60° Pleochroismus nicht bekannt Weitere Eigenschaften Phasenumwandlungen teilweiser Übergang in Pseudowollastonit oberhalb 1120 °C Schmelzpunkt 1540 °C Chemisches Verhalten Unlöslich in Wasser
Gut löslich in SalzsäureÄhnliche Minerale Bustamit, Pektolith, Serandit Radioaktivität nicht radioaktiv Magnetismus nicht magnetisch Besondere Kennzeichen manchmal fluoreszierend Wollastonit (selten auch Tafelspat oder Tafelspath) ist ein häufig auftretendes Mineral mit der chemischen Zusammensetzung CaSiO3, genauer Ca3[Si3O9]. Chemisch gesehen ist Wollastonit ein Calcium-Salz der Metakieselsäure und zählt daher zur Mineralklasse der Silicate. Seine Kristallstruktur besteht aus (SiO3)2−-Ketten, die über die Calcium-Kationen untereinander verknüpft werden. Als ein Einfach-Kettensilicat ist Wollastonit Teil der Inosilicate, gehört aber hierbei nicht zur Mineralgruppe der Pyroxene, die oft fälschlicherweise als Synonym für Einfach-Kettensilicate verwendet wird, sondern zu den Pyroxenoiden (Pyroxenähnliche), da die (SiO3)2−-Ketten in seiner Kristallstruktur einem anderen Verknüpfungsmuster folgen. Wollastonit ist farblos und kristallisiert im triklinen Kristallsystem. Er entsteht durch Kontaktmetamorphose aus Kalkstein und ist ein gesteinsbildender Bestandteil des metamorphen Gesteins Skarn.
Inhaltsverzeichnis
Etymologie und Geschichte
Der Name Wollastonit geht auf J. Léman zurück, der den Namen erstmals 1818 im Nouveau dictionnaire d’histoire naturelle appliquée aux arts à l’agriculture bei der Beschreibung von Gesteinen, genauer eines Skarn aus Dognecea im rumänischen Teil des Banat, erwähnt. Die Erstbeschreibung des Minerals erfolgte jedoch bereits 1793 durch den österreichischen Mineralogen A. Stütz in Neue Einrichtung der k.-k. Naturalien-Sammlung zu Wien, der das Mineral Tafelspath nannte. Stütz hatte hierfür Handstücke (handgroße Gesteinsproben) aus dem Banat zur Verfügung, ob diese jedoch ebenfalls aus Dognecea stammten ist nicht gesichert. Dognecea gilt trotzdem heute als Typlokalität des Tafelspath beziehungsweise Wollastonit. Die Umbenennung des Tafelspath in Wollastonit durch Léman war als Anerkennung für die wissenschaftlichen Verdienste des berühmten englischen Naturforschers William Hyde Wollaston (1766–1828) gedacht.
Seit der Gründung der International Mineralogical Association (IMA) 1958, ist Wollastonit der international anerkannte Mineralname für das natürlich auftretende CaSiO3.Modifikationen
Wollastonit existiert in mehreren Modifikationen mit der gleichen chemischen Formel, aber unterschiedlichen Kristallstrukturen, von denen in der Natur nur zwei auftreten. Da alle Modifikationen chemisch identisch sind, werden sie auch als Polymorphe bezeichnet.
Der Name Wollastonit ohne Zusatz beschreibt in der Regel die weitaus häufigste Form, den triklin kristallisierenden Wollastonit-1T (1 steht hierbei für „die erste Form“, T für triklin), der gelegentlich auch als Wollastonit-1A oder α-CaSiO3 bezeichnet wird. In englischer Literatur findet sich zudem die Bezeichnung Wollastonite-Tc (Tc = Triclinic).
Die zweite natürliche Form ist der monokline Wollastonit-2M (2 = „die zweite Form“, M = monoklin), der deutlich seltener als der trikline Wollastonit-1T auftritt. Synonyme für Wollastonit-2M sind Parawollastonit und, eigentlich inkonsequenter Weise, ebenfalls α-CaSiO3. Die Bezeichnung α-CaSiO3 wird für Wollastonit-1T und Wollastonit-2M verwendet, da beide als Tieftemperatur-Modifikationen angesehen werden. Wollastonit-2M tritt gewöhnlich jedoch nicht zusammen mit Wollastonit-1T auf, sondern ist in metamorphen Gesteinen enthalten, die bei sehr niedrigem Druck während der Metamorphose entstanden sind.
Die Hochtemperaturmodifikation wird als Pseudowollastonit (manchmal auch Wollastonit-4A) oder β-CaSiO3 bezeichnet und ist nur bei Temperaturen oberhalb 1120 °C stabil. Pseudowollastonit kristallisiert ebenfalls monoklin, besitzt aber aufgrund des sehr nahe bei 90° liegenden β-Winkels seiner Elementarzelle eine pseudo-orthorhombische Struktur. Während Wollastonit-1T und Wollastonit-2M zu den Einfach-Kettensilicaten (Inosilicate) gehören, bilden die Silicate in Pseudowollastonit ringförmige Strukturen. Pseudowollastonit zählt damit zur Gruppe der Ringsilicate (Cyclosilicate), die Anordnung der SiO4-Tetraeder ist eher mit der Struktur von Benitoit (BaTi[Si3O9]) vergleichbar.
Weitere Modifikationen wurden in Hochdruckexperimenten aus Wollastonit-1T gewonnen, sie kristallisieren alle triklin, wobei sich wiederum Änderungen in den Kristallstrukturen ergeben. Zu den Hochdruckmodifikationen zählen Wollastonit-3T, Wollastonit-4T, Wollastonit-5T und Wollastonit-7T.
Bildung und Fundorte
Wollastonit tritt häufig in Metamorphiten auf, die aus karbonathaltigem Gestein entstanden sind, und ist ein gesteinsbildender Bestandteil des Skarn. Er entsteht typischerweise bei der Kontaktmetamorphose durch den Kontakt von Kalkstein mit kieselsäurehaltigem Magma. Bei Temperaturen von mehr als 600 °C kommt es zur so genannten Wollastonitreaktion:
- Calcit + Quarz
 Wollastonit + Kohlenstoffdioxid
Wollastonit + Kohlenstoffdioxid
Da bei der Reaktion CO2 als Gas entweicht, verschiebt sich das Gleichgewicht dem Prinzip von Le Chatelier folgend auf die Seite der Produkte, das heißt die Reaktion läuft vollständig ab und ist in der Natur praktisch nicht reversibel. Die Wollastonitreaktion ist daher ein klassisches Beispiel für die Metasomatose. Bei einer normalen Metamorphose ändert sich für gewöhnlich zwar das Gefüge und meistens auch der Mineralinhalt des Gesteins, die durch die Metamorphose entstandenen Minerale besitzen jedoch weitgehend die gleiche chemische Zusammensetzung wie die ursprünglich vorhandenen Minerale. Bei der Metasomatose, wie hier im Fall der Wollastonitreaktion, ändert sich auch der Chemismus des Gesteins.
Wollastonit kann Spuren bis hin zu größeren Mengen von Eisen und Mangan in Form von zweiwertigen Kationen auf den Plätzen der Ca2+-Kationen im Kristallgitter besitzen. Hohe Eisen- und Mangananteile machen sich vor allem bei der Betrachtung des Minerals in Gesteinsdünnschliffen am Polarisationsmikroskop durch höhere Brechzahlen bemerkbar. Seltener befinden sich auch Magnesium- (Mg2+), Aluminium- (Al3+) oder Natrium- (Na+) und Kalium-Kationen (K+) auf den Calcium-Positionen. Bei Eisengehalten von mehr als 10 % (Ca0,9Fe0,1SiO3) beziehungsweise Mangangehalten von mehr als 25 % (Ca0,75Mn0,25SiO3) kristallisiert Wollastonit in der Struktur von Bustamit ((Mn,Ca,Fe)[SiO3]). Zu den strukturell verwandten Mineralen von Wollastonit zählen neben Bustamit auch Pektolith (NaCa2[Si3O8(OH)]) und Serandit (Na(Mg,Ca)2[Si3O8(OH)]).
Begleitende Minerale (Paragenesen) von Wollastonit sind typischerweise Diopsid, verschiedene Granate (vor allem Grossular und Andradit), Tremolit, Vesuvian (Idokras), Mikroklin und Calcit.
Wollastonit tritt weltweit an zahlreichen Fundorten auf und wird auch zur industriellen Verwendung abgebaut. Die Angaben zur Produktion beziehen sich auf den World Mineral Report des British Geological Survey von 2005: [1]
- China (Hauptproduzent auf dem Weltmarkt), 350.000 t
- Indien, 128.285 t
- USA in Willsboro (New York) und Gouverneur (New York) 120.000 t
- Mexiko, Bundesstaat Chiapas, 27.123 t
- Finnland, 15,950 t
- Namibia, 253 t
Fundorte ohne kommerziellen Abbau:
- Sachsen (Deutschland)
- Banat (Rumänien)
- Vesuv und Monte Somma (Italien)
- Franklin (New Jersey, USA)
Die Wollastonite aus Franklin (New Jersey) zeichnen sich häufig durch eine blaue bis weiße Fluoreszenz unter Einwirkung von UV-Licht aus. Diese wird, wie auch die Fluoreszenz im Mineral Fluorit, durch sehr geringe Mengen von Europium-Kationen (Eu2+) auf den Calcium-Positionen im Kristallgitter verursacht.
Struktur
In der Natur tritt Wollastonit normalerweise als Wollastonit-1T auf. Wollastonit-1T kristallisiert im triklinen Kristallsystem in der Kristallklasse
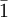 beziehungsweise der Raumgruppe
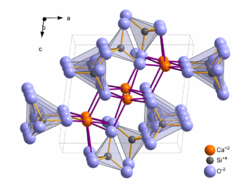
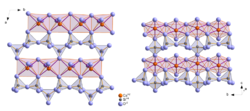
beziehungsweise der Raumgruppe 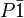 mit sechs Formeleinheiten in der Elementarzelle (Z=6). Das einzige Symmetrieelement in der Kristallstruktur ist ein Inversionszentrum, das die Atome durch Punktspiegelung vervielfältigt. Die Inversionszentren befinden sich in den Ecken, auf den Flächenmittelpunkten sowie im Zentrum der Elementarzelle. Die Kristallstruktur enthält drei kristallographisch unterscheidbare Calcium- und Siliziumatome sowie neun unterschiedliche Sauerstoffatome. Kristallographisch unterscheidbar bedeutet, dass diese Atome nicht durch die vorhandenen Symmetrieelemente (in diesem Fall das Inversionszentrum) in einander überführbar sind. Durch das Inversionszentrum werden die drei Calcium- und Siliziumatome sowie die neun Sauerstoffatome verdoppelt, so dass sich insgesamt die oben beschriebenen sechs Formeleinheiten (6 x CaSiO3 = „Ca6Si6O18“) in der Elementarzelle befinden.
mit sechs Formeleinheiten in der Elementarzelle (Z=6). Das einzige Symmetrieelement in der Kristallstruktur ist ein Inversionszentrum, das die Atome durch Punktspiegelung vervielfältigt. Die Inversionszentren befinden sich in den Ecken, auf den Flächenmittelpunkten sowie im Zentrum der Elementarzelle. Die Kristallstruktur enthält drei kristallographisch unterscheidbare Calcium- und Siliziumatome sowie neun unterschiedliche Sauerstoffatome. Kristallographisch unterscheidbar bedeutet, dass diese Atome nicht durch die vorhandenen Symmetrieelemente (in diesem Fall das Inversionszentrum) in einander überführbar sind. Durch das Inversionszentrum werden die drei Calcium- und Siliziumatome sowie die neun Sauerstoffatome verdoppelt, so dass sich insgesamt die oben beschriebenen sechs Formeleinheiten (6 x CaSiO3 = „Ca6Si6O18“) in der Elementarzelle befinden.Die kristallographischen Daten von Wollastonit-1T sind im Vergleich mit den beiden anderen Modifikationen in der Tabelle angegeben.
Kristallographische Daten für Wollastonit Name Wollastonit-1A(ex.1T)
WollastonitWollastonit-2M
ParawollastonitWollastonit-4A
PseudowollastonitKristallsystem trikllin monoklin monoklin Kristallklasse 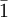
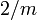
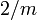
Raumgruppe 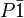
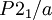
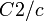
Gitterkonstanten der
Elementarzellea = 794 pm
b = 732 pm
c = 707 pmα = 90,03°
β = 95,37°
γ = 103,43°a = 1543 pm
b = 732 pm
c = 707 pmα = 90°
β = 95,40°
γ = 90°a = 684 pm
b = 1187 pm
c = 1963 pmα = 90°
β = 90,67°
γ = 90°Zahl der Formeleinheiten in der Elementarzelle 6 12 8 Koordinationsumgebung der Ca2+- und Si4+-Kationen
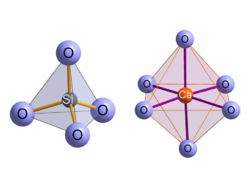
Wie in fast allen Silicaten wird das Silicium von vier Sauerstoffatomen in Form eines Tetraeders umgeben. Diese SiO4-Tetraeder liegen jedoch nicht isoliert in der Kristallstruktur vor, sondern sind zu Ketten verknüpft (siehe nächster Abschnitt). Die Sauerstoff-Silizium-Abstände liegen zwischen 157 und 166 pm, was den üblichen Abständen in Silicaten entspricht.
Die Calciumatome werden jeweils von sechs Sauerstoffatomen in Form von verzerrten Oktaedern umgeben, die Calcium-Sauerstoffabstände liegen zwischen 227 und 255 pm.Verknüpfungsmuster der Silicatketten
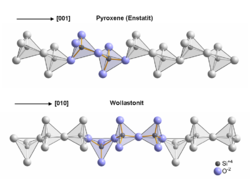
Obwohl Wollastonit zu den Einfach-Kettensilicaten (Inosilicate) gehört, unterscheidet sich das Verknüpfungsmuster der SiO4-Tetraeder innerhalb der Silicatkette von dem der weitaus häufigeren Pyroxene. Der Unterschied wird im Vergleich von Wollastonit mit dem Pyroxen Enstatit (MgSiO3) deutlich.
Die Verknüpfung der SiO4-Tetraeder erfolgt in allen Kettensilicaten über gemeinsame Tetraederecken, also über gemeinsame Sauerstoffatome. Damit eine Kette entsteht, muss jedes Silizium zwei der Sauerstoffatome seines Tetraeders mit den benachbarten Siliziumatomen teilen, diese Sauerstoffatome „gehören“ ihm also nur zur Hälfte. Damit ergibt sich in der Kette ein Silizium-Sauerstoff-Verhältnis von 1:3, was sich auch in der chemischen Formel der Kettensilicate widerspiegelt (Wollastonit: CaSiO3, Enstatit: MgSiO3). Diese Ketten sind praktisch unendlich, sie werden nur von der Größe des Kristalls begrenzt. In der Kristallchemie werden sie daher folgendermaßen beschrieben: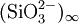 oder ausführlicher als Niggli-Formel:
oder ausführlicher als Niggli-Formel: ![{}^1_\infty\mathrm{\lbrace[SiO_{2/2}O_{2/1}]^{2-}}\rbrace](/pictures/dewiki/97/ad230db000c87806f659c30242f0c2db.png)
Die Ketten können nun durch die Orientierung der SiO4-Tetraeder zueinander weiter unterschieden werden. Während sich im Enstatit und allen anderen Pyroxenen das gleiche Motiv nach zwei Tetraedern wiederholt, wird das Kettenmuster im Wollastonit durch drei Tetraeder vorgegeben. Vereinfacht ausgedrückt zeigen im Enstatit die Tetraeder mit einer Spitze abwechselnd „nach oben“ und „nach unten“, während im Wollastonit ein Tetraeder mit der Spitze „nach unten“ zeigt, die nächsten beiden jedoch „nach oben“. Im Fall der Pyroxene spricht man daher auch von einer „Zweiereinfachkette“, Wollastonit besitzt eine „Dreiereinfachkette“. Da das zugrunde liegende Motiv der Ketten in Wollastonit aus drei Tetraedern besteht, wird die chemische Formel auch häufig verdreifacht, Ca3[Si3O9], angegeben. Die unendlichen (SiO3)2--Ketten verlaufen in der Kristallstruktur von Wollastonit in Richtung [010], das heißt in Richtung der kristallographischen b-Achse. Das Kettenmotiv aus drei Tetraedern wiederholt sich nach 732 pm, was exakt der Gitterkonstante der Elementarzelle in Richtung der b-Achse entspricht. Die kompliziertere Anordnung der Tetraeder in Wollastonit erfolgt aufgrund des erhöhten Platzbedarfs der Ca2+-Kationen (Ca2+ ist größer als die häufig in Pyroxenen enthaltenen Mg2+- und Fe2+-Kationen) in der Kristallstruktur.
Gesamtstruktur
Die [CaO6]-Oktaeder bilden ihrerseits über gemeinsame Kanten ebenfalls Ketten in Richtung der b-Achse. Die Oktaederketten sind über gemeinsame Sauerstoffatome mit den oben beschriebenen Silicatketten in Richtung der a- und c-Achse verknüpft, wodurch eine dreidimensionale Struktur entsteht.
Einfluss der Struktur auf die makroskopischen Eigenschaften
Anhand der Kristallstruktur lassen sich einige makroskopische Eigenschaften von Wollastonit erklären. Einkristalle von Wollastonit besitzen eine nadelige bis faserige Form (Habitus), da die Kristalle bevorzugt in Richtung der kristallographischen b-Achse wachsen, was der Orientierung der Silicatketten in der Kristallstruktur entspricht. Bricht man eine Wollastonit-Nadel in der Mitte durch, das heißt man zerbricht die Silicatketten, ergeben sich unebene Bruchflächen während bei mechanischer Belastung parallel zur b-Abchse ebene Spaltflächen ({100} vollkommene, {001} und {102} gute Spaltbarkeit) entstehen. Dies lässt sich auch durch die chemischen Bindungsverhältnisse im Kristall erklären. Während Silizium und Sauerstoff über kovalente Bindungen (Atombindungen) miteinander verbunden sind, besteht zwischen Calcium und Sauerstoff eine Ionische Bindung, die auf einer rein elektrostatischen Wechselwirkung beruht und somit die schwächere Bindung darstellt.
Verwendung
Wollastonit bietet aufgrund seiner faserig bis nadeligen Kristalle und seines hohen Schmelzpunktes (1540 °C) vielfältige technische Einsatzmöglichkeiten. Seine Herstellung erfolgt dabei über die Reaktion von Calciumoxid (CaO, Branntkalk) mit Siliciumdioxid (SiO2, Quarz beziehungsweise Kieselgel) :
Eines der Haupteinsatzgebiete von Wollastonit ist die Keramikindustrie, wo er zur Verbesserung der mechanischen Eigenschaften weißer Keramikwaren verwendet wird.
Aufgrund seines hohen Schmelzpunktes dient Wollastonit als Ersatz für Asbestfasern. Typischerweise wird er in Schweißelektroden, Dämmstoffen (siehe Calciumsilicat-Platte) und feuerfester Schutzkleidung eingesetzt. Während Asbestfasern zu den krebserzeugenden Arbeitsstoffen zählen, geht von Wollastonitfasern kein Gesundheitsrisiko aus, da diese sich innerhalb weniger Tage bis einigen Wochen im Organismus auflösen.
In der Kunststoffindustrie wird Wollastonit hauptsächlich als Füllstoff in Thermoplasten verwendet. Er dient unter anderem zur Verbesserung der Steifigkeit und Biegefestigkeit von Polyestern, Polyamiden und Polypropylenen.
Für Wollastonit existieren zahlreiche Handelsnamen, darunter Kemolit, Hycon und Tremin.
Siehe auch
Literatur
- N. L. Bowen, J. F. Schairer, E. Posnjak (1933): The system CaO-FeO-SiO2. American Journal of Science, Series 5, 26, 193-283. (englisch)
- M. J. Buerger, C. T. Prewitt (1961): The crystal structures of wollastonite and pectolite. Proceedings of the National Academy of Sciences, U.S.A., 47, 1884–1888. (englisch)
- W. A. Deer, R. A. Howie, J. Zussman: An Introduction to the Rock Forming Minerals. Prentice Hall, Harlow 1992, ISBN 0-582-30094-0 (englisch)
- R. I. Harker, O. F. Tuttle (1956): Experimental data on the P(CO2)-T curve for the reaction: calcite + quartz ↔ wollastonite + carbon dioxide. American Journal of Science, 254, 239-256. (englisch)
- U. Müller: Anorganische Strukturchemie. Teubner, Stuttgart 2004, ISBN 3-519-33512-3
- Y. Ohashi (1984): Polysynthetically-twinned structures of enstatite and wollastonite. Physics and Chemistry of Minerals, 10, 217-229. (englisch)
- M. Okrusch, S. Matthes: Mineralogie. Springer, Berlin 2005, ISBN 3-540-23812-3
- H.-X. Yang, C. T. Prewitt (1999): On the crystal structure of pseudowollastonite (CaSiO3). American Mineralogists, 84, 929-932. (englisch)
Einzelnachweise
- ↑ British Geological Survey: World mineral production 2001-05. 2007, S. 78.
Weblinks
- Calcit + Quarz
Wikimedia Foundation.