- para-Toluolsulfonsäurechlorid
-
Strukturformel 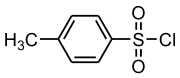
Allgemeines Name para-Toluolsulfonsäurechlorid Andere Namen - Toluol-4-sulfonylchlorid
- Toluol-4-sulfonsäurechlorid
- 4-Methylbenzol-1-sulfonylchlorid
- p-Toluolsulfochlorid
- Tosylchlorid
- p-Toluolsulfonylchlorid
- Toluol-4-sulfochlorid
- TosCl
- TsCl
Summenformel C7H7ClO2S CAS-Nummer 98-59-9 PubChem 7397 Kurzbeschreibung weißer bis grauer Feststoff[1]
Eigenschaften Molare Masse 190,64 g·mol−1 Aggregatzustand fest
Dichte 1,49 g·cm−3[1]
Schmelzpunkt Siedepunkt 135 °C (13 hPa)[1]
Dampfdruck Löslichkeit Zersetzung mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Gefahr
H- und P-Sätze H: 315-318 EUH: keine EUH-Sätze P: 280-305+351+338 [2] EU-Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34 S: 26-36/37/39-45 LD50 4680 mg·kg−1 (Ratte, oral)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. para-Toluolsulfonsäurechlorid ist eine chemische Verbindung aus der Gruppe der Sulfonsäuren. Sie ist das Säurechlorid der para-Toluolsulfonsäure und wird umgangssprachlich oft als Tosylchlorid, geschrieben TsCl, bezeichnet. Dabei steht die Abkürzung „Ts“ für eine Tosylgruppe.[4]
Inhaltsverzeichnis
Darstellung
Die Verbindung kann durch eine Reaktion ähnlicher einer Friedel-Crafts-Alkylierung aus Toluol hergestellt werden. Hierzu wird Toluol mit Sulfurylchlorid und Aluminiumchlorid als Katalysator zur Reaktion gebracht.[5]
Eine weitere Möglichkeit besteht in der Umsetzung von para-Methylanilin in einer sandmeyer-ähnlichen Reaktion. Hierzu wird das Amin zunächst mit Natriumnitrit diazotiert. Das entstandene Diazoniumsalz wird dann mit Schwefeldioxid in Gegenwart von Kupfer(I)-chlorid und Magnesiumchlorid zur Reaktion gebracht.[6]
Tosylchlorid ist ein Abfallprodukt der Saccharin-Herstellung. Hier entstehen neben dem hierfür benötigte o-Toluolsulfonylchlorid auch das p-Toluolsulfonylchlorid welches nach der Trennung voneinander als Feinchemikalie veräußert wird.[7]
Eigenschaften
para-Toluolsulfonsäurechlorid ist ein ätzender Feststoff mit einem charakteristischem eigentümlichem Geruch, der bei 67 °C schmilzt und bei 135 °C bei einem Druck von 13 hPa siedet. Ab einer Temperatur von 220 °C zersetzt er sich.[1]
Verwendung
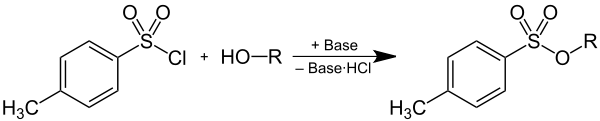
Tosylate können durch Deprotonierung eines Alkohols und anschließender Reaktion mit p-Toluolsulfonsäurechlorid hergestellt werden, wobei ein Äquivalent Chlorwasserstoff, der durch eine Base als Hydrochlorid gebunden wird, entsteht:
Auf Grund ihrer Eigenschaft als Abgangsgruppe werden Tosylate als Zwischenprodukte in der präparativen Organischen Chemie verwendet. Durch Überführung von Alkoholen in Tosylate wird die schlechte Abgangsgruppe HO– in eine gute Abgangsgruppe überführt, wodurch Substitutionsreaktionen an dieser Position des Kohlenstoffgerüstes ermöglicht werden. Das Anion der p-Toluolsulfonsäure tritt dabei als Abgangsgruppe aus.
Literatur
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 98-59-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2008 (JavaScript erforderlich).
- ↑ a b Datenblatt p-Toluenesulfonyl chloride bei Sigma-Aldrich, abgerufen am 16. April 2011.
- ↑ Datenblatt Para-Toluolsulfonsäurechlorid bei Merck, abgerufen am 18. Januar 2011.
- ↑ Paula Yurkanis Bruice: Organic Chemistry, Pearson Education Inc., 2004, 4. Auflage, S. 444, ISBN 0-13-121730-5.
- ↑ A. Töhl, O. Eberhard: Ueber die Einwirkung des Sulfurylchlorids auf aromatische Kohlenwasserstoffe, in: Chem. Ber. 1893, 26, 2940–2945; doi:10.1002/cber.189302603118.
- ↑ H. Meerwein, G. Dittmar, R. Göllner, K. Hafner, F. Mensch, O. Steinfort: Untersuchungen über aromatische Diazoverbindungen, II. Verfahren zur Herstellung Aromatischer Sulfonsäurechloride, Eine Neue Modifikation der Sandmeyerschen Reaktion, in: Chem. Ber. 1957, 90, 841–852; doi:10.1002/cber.19570900602.
- ↑ H. Beyer, W. Walter: Lehrbuch der organischen Chemie, S. Hirzel Verlag, Stuttgart 1981, 19. Auflage, S. 514; ISBN 3-7776-0356-2.
Wikimedia Foundation.