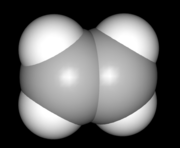
- Ethylen
-
Strukturformel 
Allgemeines Name Ethen Andere Namen - Ethylen
- Äthen
- Äthylen
- Elaylgas
- Vinylwasserstoff
- Etherin
- Acetan
- R 1150 (als Kältemittel)
Summenformel C2H4 CAS-Nummer 74-85-1 PubChem 6325 Kurzbeschreibung hochentzündliches, farbloses Gas mit schwach süßlichem Geruch [1] Eigenschaften Molare Masse 28,05 g·mol−1 Aggregatzustand gasförmig
Dichte 1,178 kg·m−3 (15 °C) [1]
Schmelzpunkt −169,18 °C [1]
Siedepunkt −103,72 °C [1]
Dampfdruck Löslichkeit sehr schlecht in Wasser: 130 mg·l−1 [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12-67 S: (2)-9-16-33-46 MAK nicht festgelegt, da möglicherweise erbgutverändernd
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethen (standardsprachlich: Äthen; veraltet auch: Ethylen, Äthylen) ist ein farbloses, süßlich riechendes Gas. Es ist das einfachste Alken, ein ungesättigter Kohlenwasserstoff mit einer Kohlenstoff-Kohlenstoff-Doppelbindung. Für die Petrochemie stellt Ethen die wichtigste Grundchemikalie dar. Außerdem hat es als Phytohormon große Bedeutung.
Inhaltsverzeichnis
Geschichte
Ab 1795 wurde Ethen Olefingas genannt, weil es durch Reaktion mit Chlor das ölige 1,2-Dichlorethan bildet, das erstmals 1785 von vier niederländischen Chemikern synthetisiert wurde.
In der Mitte des 19. Jahrhunderts wurde das Suffix -en unter der Bedeutung verwandt mit verwendet, so wurde von dem Ethylrest (C2H5) das Gas Ethylen abgeleitet. Dieser Name wurde bis 1852 verwendet.
1866 wurde es nach der Nomenklatur von August Wilhelm von Hofmann in Ethen umbenannt. Diese Nomenklatur war schließlich auch Basis für die IUPAC-Nomenklatur.
Es gibt keine genauen Daten zur Erstentdeckung des Ethens, aufgrund der oben genannten Daten kann davon ausgegangen werden, dass es schon mehrere Jahrhunderte, wenn nicht länger, bekannt ist.
1807 versuchte John Dalton eine richtige Strukturformel aufzustellen. In der zweiten Hälfte des 19. Jahrhunderts gelang die synthetische Darstellung pflanzlicher Säuren wie zum Beispiel der Bernsteinsäure aus Ethen.
Gewinnung und Darstellung
Deutschland (2,9 Mio Tonnen 1989) ist in Europa der größte Ethenhersteller, gefolgt von Frankreich (2,5 Mio Tonnen) und England (1,9 Mio Tonnen).
Ursprünglich wurde Ethen durch Dehydratisierung von Ethanol oder durch Isolierung aus Kokereigas gewonnen. Das heutzutage technisch relevante Verfahren ist das Steamcracken von Naphtha oder höheren Kohlenwasserstoffgemischen wie Hydrowax.
Im Labor wird es durch Eliminierung von 1,2-Dichlorethan und Zink gewonnen.
Ethen-Pipelinesystem
In Deutschland und Teilen der Niederlande besteht ein Ethen-Pipelinesystem zum Transport zwischen den einzelnen Chemiestandorten von Rotterdam über Antwerpen in den Raum Köln und weiter in den Emscher-Lippe-Raum, sowie in das Rhein/Main-Gebiet und nach Ludwigshafen. Die Landesregierungen von Niedersachsen und Schleswig-Holstein unterstützen die Ethen-Pipeline vom Ruhrgebiet an die deutsche Küste.
Gleichzeitig sollen die nördlich und südlich der Elbe gelegenen Industriestandorte Brunsbüttel und Stade mit einer 54 Kilometer langen Chemie- und Gas-Pipeline verbunden werden. Schleswig-Holstein und Niedersachsen wollen mit der Pipeline die Rohstoffversorgung der Chemieunternehmen an der Küste und damit die Absatzmöglichkeiten für ihre Produkte im deutschen und europäischen Raum verbessern. Die geplante Verbindung ist zugleich ein Element im Chem-Coast-Projekt des Verbands der Chemischen Industrie (VCI). In Stade besteht Anschluss an eine Ethen-Pipeline nach Böhlen in Sachsen. Darüber hinaus ist eine weitere Verbindung von Stade über Wilhelmshaven nach Gelsenkirchen vorgesehen, wo jeweils große chemische Fabriken bestehen.
In Bayern besteht momentan eine Pipeline zwischen dem Chemiedreieck im Süden und dem Chemiestandort bei Ingolstadt (Ethylen-Pipeline Münchsmünster-Gendorf). Im September 2007 hat die EPS Ethylen-Pipeline-Süd GmbH & Co. KG mit dem Bau der 360 km langen Ethylen Pipeline Süd von Münchsmünster nach Ludwigshafen begonnen, die bis Ende 2008 den Anschluss an den nordwesteuropäischen Ethen-Verbund herstellen soll.
Eigenschaften
Moleküleigenschaften
Zwischen den beiden Kohlenstoff-Atomen besteht eine Doppelbindung. Für eine Rotation um diese Bindung ist ein erheblich größerer Energieaufwand nötig als für die Rotation um eine Kohlenstoffeinfachbindung (siehe auch harmonischer Oszillator (Quantenmechanik)). Aufgrund der sp2-Hybridisierung der Kohlenstoffatome ist das Molekül planar, das heißt alle Atome liegen in einer Ebene. Der Winkel zwischen den zwei Kohlenstoff-Wasserstoff-Bindungen beträgt 117° und weicht damit nur leicht vom theoretischen Wert der trigonal planaren Form mit 120° ab. Der C-C-Bindungsabstand beträgt 133 pm und ist damit deutlich kleiner als der C-C-Bindungsabstand von Ethan. Die beiden Bindungen zwischen den Kohlenstoffatomen sind nicht gleich stark: Die Bindungsstärke der σ-Bindung beträgt ca. 450 kJ/mol, die der π-Bindung ca. 270 kJ/mol. Entsprechend lässt sich die π-Bindung, beispielsweise in einer chemischen Reaktion, leicht spalten. Allgemein ist Ethen aufgrund der hohen Elektronendichte zwischen den beiden Kohlenstoff-Atomen wesentlich reaktiver als zum Beispiel das Ethan.
Physikalische Eigenschaften
Auf Grund der reaktiven C=C-Doppelbindung ist die Addition an diese Bindung eine typische Reaktion des Ethens. In Wasser sind nur 130 mg/l Ethen löslich, in organischen (unpolaren) Lösungsmitteln ist Ethen jedoch gut löslich. Ethen hat einen leicht süßlichen, unangenehmen Geruch. Die Geruchsschwelle liegt bei 260 ml/m3. Der Heizwert von Ethen beträgt 59,955 MJ/m3.
Weitere Eigenschaften:
- Schmelzwärme: 3,35 kJ/mol
- Verdampfungswärme: 13,9 kJ/mol
- Cp: 42,9 J/(mol · K)
- ΔfH0g: 52,47 kJ/mol
- S0: 219,32 J/(mol · K)
Chemische Eigenschaften
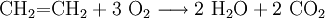
- Ethen verbrennt bei optimaler Sauerstoffzufuhr zu Wasser und Kohlendioxid
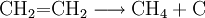
- Bei Hitze und unter Luftabschluss zerfällt Ethen zu Methan und Kohlenstoff.
Ethen geht als ungesättigter Kohlenwasserstoff Additionsreaktionen mit Wasserstoff, Wasser und Halogenen ein:
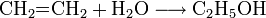
- Ethen reagiert mit Wasser zu Ethanol, allerdings ist die Reaktionsgeschwindigkeit ohne geeigneten Katalysator sehr gering.
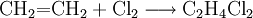
- Ethen reagiert mit Chlor zu 1,2-Dichlorethan (Additionsreaktion).
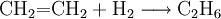
- Ethen reagiert mit Wasserstoff unter hohem Druck und der Anwesenheit von metallischen Katalysatoren wie Platin und Nickel zu Ethan.
![\mathrm{n \ CH_2{=}CH_2 \longrightarrow [-CH_2{-}CH_2-]_n}](/pictures/dewiki/50/248c0fc8ec7ad5f37b144fcd7b18a9da.png)
- Ethenmoleküle polymerisieren, radikalisch unter hohem Druck, oder mit Hilfe von Ziegler-Katalysatoren, zu Polyethylen.
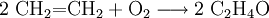
- Mit Luft oder Sauerstoff und Silber als Katalysator erfolgt bei einer Temperatur von 220 bis 280 °C und erhöhtem Druck eine Epoxidation zu Ethylenoxid.
Nachweis
Ethen kann mit Hilfe von Bromwasser nachgewiesen werden, da bei der Reaktion der beiden Stoffe das Brom verbraucht und dadurch das bräunliche Bromwasser durch das Ethen entfärbt wird.
Verwendung
Die wichtigsten Folgeprodukte des Ethens sind das Polyethylen (56 %), Ethylendichlorid zur Herstellung von PVC (14 %), Ethylenoxid (11 %) und Ethylbenzol (7 %) zur Herstellung von Polystyrol. Das bedeutet, dass mit Ausnahme des Ethylenoxids, das Beispielsweise zur Herstellung von nichtionischen Tensiden (Waschmittel) verwendet wird, mehr als 75 % des Ethens zur Herstellung von Kunststoffen verwendet wird.
Daneben ist Ethen Ausgangsstoff zur Herstellung zahlreicher organischer Verbindungen wie Anthracen, 2-Chlorethanol, Chlorethan, Propanal, Isopren, Vinylacetat, Propansäure, Buten, Styrol, Ethandiol und weiteren Stoffen. Im Wacker-Verfahren wird Ethen großtechnisch unter Verwendung von molekularem Sauerstoff in Acetaldehyd (Ethanal) umgesetzt (ca. 1,3 % des Ethenverbrauchs).
Ethen war als Betäubungsmittel neben Lachgas bis vor wenigen Jahren vor allem bei schwachen Betäubungen in Gebrauch. Es wirkt narkotisch und muskelentspannend. 1923 wurde es in Chicago zum ersten Mal öffentlich benutzt, die narkotische Wirkung des Ethens ist etwas stärker als die des Lachgases und hat einen ähnlichen Wirkmechanismus. Heute wird es jedoch nicht mehr verwendet, da es brennbar ist und unangenehm riecht. Außerdem ist die Narkosewirkung des Ethens im Vergleich zu anderen gebräuchlichen Betäubungsmitteln nicht sehr gut, um eine gute Wirkung zu erzielen müsste das Narkosegemisch mindestens 80 % Ethen enthalten.
Auch zum Reifen unreifer Früchte wie dem Apfel, Bananen und Tomaten wird es benutzt (siehe Biologische Wirkung). Ethen ist des Weiteren ein Brenngas und wird für Hochgeschwindigkeits-Flammspritzen verwendet. Ethen ist in der chemischen Industrie Ausgangsstoff für die Synthese von über 30 % aller Petrochemikalien, es hat das Ethin nach dem Zweiten Weltkrieg weitestgehend verdrängt, weil Ethin teurer herzustellen ist, während Ethen bei industriellen Prozessen massenhaft anfällt, seitdem Erdöl in großen Mengen zu Verfügung steht.
Außerdem wird es zur Herstellung von Schädlingsbekämpfungsmitteln und chemischer Waffen wie dem Senfgas ( 2,2-Dichlordiethylsulfid) verwendet.
Während des Zweiten Weltkrieges wurde Ethengas von dem Spezialtrupp Taifun beim Angriff auf Festungen experimentell eingesetzt.
Biologische Wirkung
Ethen ist ein Phytohormon (Pflanzenhormon). Es wird von Pflanzen ausgehend von der Aminosäure Methionin synthetisiert, teilweise stimuliert durch das Phytohormon Auxin. Als Hormon beeinflusst es das Keimwachstum und die Seneszenz bei Pflanzen. Es bewirkt die Fruchtreifung, die Entwicklung der Blüten, den Abwurf der Blätter im Herbst sowie das Absterben von Pflanzenteilen. Als gasförmigen Stoff findet man Ethen dabei vor allen in den Räumen zwischen den Zellen, den Interzellularen.
Bereits 1901 zeigte Dimitri Neljubow, dass Ethen bei Pflanzen die so genannte Tripleresponse auslöst. Diese tritt bei keimenden Wurzeln auf, die mit Ethen begast werden. Aufgefallen war der Effekt bei Pflanzen an defekten Stadtgasleitungen, die ein ungewöhnliches Wachstum zeigten. Es handelt sich dabei um eine Hemmung des Längenwachstums in Zusammenwirken mit einer Verdickung des Stängel und eine Deaktivierung des Gravitropismus, also des Wachstums in Richtung der Erdanziehungskraft. Diese Wirkung kommt zustande durch eine Umorientierung der Microtubuli, die als Skelettstrukturen die Wachstumsrichtung (Anlagerung von Cellulosefasern) des Keimes vorgeben. Sie werden von einer vertikalen in eine horizontale Orientierung gebracht. Als biologischer Sinn wird die Überwindung von Hindernissen angenommen: Ethen wird während des gesamten Wachstums gebildet und staut sich vor Hindernissen, an diesen kommt es zum Dickenwachstum und somit zu einer größeren Kraftentfaltung durch die Wurzelspitze.
Die zweite Funktion des Ethen bezieht sich auf verschiedene Alterungsprozesse der Pflanze. Dazu gehören sowohl die Reifung von Früchten und die Entwicklung von Blüten als auch der Abwurf von Blättern (Abszission) oder das Absterben von Pflanzenteilen (Seneszenz). Wichtig für diese Funktionen ist die lawinenartige Steigerung der verfügbaren Ethenmenge, die dadurch zustande kommt, dass die Synthese von Ethen durch die Präsenz desselben aktiviert wird. Auf diese Weise reift etwa eine Frucht an allen Stellen zugleich. Die Wirkung bei der Reifung von Früchten wird in der Landwirtschaft ausgenutzt, um unreif geerntete Früchte nachträglich zu Stoffwechselvorgängen zu veranlassen, die die Früchte reifen lassen.
Seit Mitte der 1990er Jahre werden durch gezielte Genveränderung Tomaten hergestellt, die besonders haltbar sind (Flavr-Savr-Tomaten). Das für die Herstellung des Ethens zuständige Gen wird dabei ausgeschaltet. Diese Tomaten können dann nach Bedarf mit Ethen begast werden und dadurch reif gemacht werden. Häufig werden Früchte beabsichtigt nicht zum Reifen gebracht, dann transportiert, und erst am Zielort mit Hilfe von Ethen gereift. Auch können unreife Tomaten reif gemacht werden, indem man einige reife Tomaten dazulegt. Diese sondern Ethen ab und bringen die unreifen Tomaten so zum Reifen.
Ebenfalls essentiell ist Ethen als „Alarmstoff“ bei Schädlingsbefall an der Pflanze sowie bei Verwundungen. Gemeinsam mit anderen Stoffen wie der Salicylsäure und Jasmonat bewirkt das Ethen eine Abgrenzung des betroffenen Bereiches sowie die Bereitstellung von pflanzlichen Giften. Als Gas wirkt Ethen dabei auch auf benachbarte Pflanzenteile oder Pflanzen und setzt auch dort die Alarmkaskade in Gang.
Der Wirkmechanismus des Ethen ist wie bei anderen Phytohormonen noch sehr wenig erforscht. Man nimmt an, dass Ethen auf spezifische Rezeptormoleküle (Ethenrezeptor ETR) an den Zellmembranen wirkt, die innerhalb der Zelle eine Wirkkaskade in Gang setzen. Konkret handelt es sich dabei um die Aktivierung der Serin-Threonin-Kinase CTR1. Das Signal wird weitergegeben an verschiedene Zellkern-Proteine (EIN3/EIL-Proteine), die als Transkriptionsfaktoren bei der Genexpression wirken und somit bestimmte Gene aktivieren. Das erste bekannte Zielgen dieser Proteine wurde als Ethen-Response-Faktor 1 (ERF1) beschrieben. Dieser Faktor steuert wiederum mehrere Gene, sodass bei der Wirkung von Ethen auf dieses System immer eine ganze Reihe von genetischen Aktivitäten ausgelöst werden. Bei der Fruchtreifung müssen etwa verschiedene Enzyme zur Erweichung der Zellwand gebildet werden, bei der Seneszenz chitin- und celluloseabbauende Enzyme (Chitinasen, Cellulasen). Sehr umfangreich ist das Repertoire beim Pflanzenstress, also der durch Ethen ausgelösten Reaktion auf Schädlinge und Verwundungen. Produziert werden in dieser Situation unter anderen Chitinasen (als Giftstoffe für Insekten), Glucanasen, Proteinase-Inhibitoren (Hemmstoffe für proteinabbauende Enzyme, gegen Pilze) und sehr viele weitere Abwehrstoffe.
Die Ethen-Synthese in der Pflanze geht von der Aminosäure Methionin aus. Dabei entsteht in einem ersten Schritt durch die Kopplung an Adenosin das S-Adenosylmethionin (SAM). Aus dem Folgeprodukt 1-Aminocyclopropancarbonsäure (ACC) wird durch die ACC-Oxidase Ethen freigesetzt. Die Bildung der Oxidase wird durch Ethen selbst stimuliert (siehe oben), wodurch wie bei einer Kettenreaktion in benachbarten Zellen die Ethenbildung vorangetrieben wird.
Gefahren
Ethen verbrennt an der Luft mit leicht rußender, leuchtender Flamme. Ethen ist hochentzündlich. Ethenbehälter müssen an einem gut belüfteten Ort aufbewahrt werden. Von Zündquellen ist es fernzuhalten, und es müssen Maßnahmen gegen elektrostatische Aufladung getroffen werden. Zwischen einem Luftvolumenanteil von 3 bis 36 Prozent bildet es explosive Gemische. In hoher Konzentration wirkt Ethen als Betäubungsmittel (siehe Verwendung).
Der Flammpunkt liegt bei −136 °C, der Zündpunkt bei 425 °C.
Quellen
- ↑ a b c d e f Eintrag zu Ethen in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12. Sep. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 74-85-1 im European chemical Substances Information System ESIS
Literatur
- Claus-Jürgen Estler: Pharmakologie und Toxikologie. Schattauer, Stuttgart 1992, 2000. ISBN 3-7945-1898-5
- Thomas Heidermann: Rußbildung in vorgemischten Ethen-Luft-Flammen bei hohem Druck. Cuvillier, Göttingen 1995. ISBN 3-89588-231-3
- Christoph Richter: Transport von Ethen durch Polyelektrolytgele mit Silberionen als Carriern. Shaker, Aachen 1995. ISBN 3-8265-0401-1
- Sven Rudolph: Synthese, Eigenschaften und Blends von Ethen/1-Hexen-Copolymeren. Tectum, Marburg 2000. ISBN 3-8288-0869-7
- Gerhard Luft: Hochdruckpolymerisation von Ethylen. in: Chemie in unserer Zeit. Wiley-VCH, Weinheim 34.2000,3, S.190-199. ISSN 0009-2851
Weblinks
Wikimedia Foundation.