- Extrauteringravidität
-
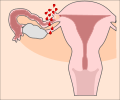
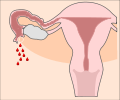
Klassifikation nach ICD-10 O00.– Extrauteringravidität O00.0 Abdominalgravidität O00.1 Tubargravidität O00.2 Ovarialgravidität O00.8 Sonstige Extrauteringravidität O00.9 Extrauteringravidität, nicht näher bezeichnet ICD-10 online (WHO-Version 2011) Als Extrauteringravidität (EUG), auch ektope Schwangerschaft, bezeichnet man eine außerhalb der Gebärmutterhöhle (Cavum uteri) eingenistete Schwangerschaft. Die meisten extrauterinen Schwangerschaften treten im Eileiter auf und werden daher Eileiterschwangerschaften genannt. Die Implantation des Embryos kann jedoch auch in den Eierstöcken und der Bauchhöhle auftreten. Schwangerschaften im Gebärmutterhals, der Gebärmutterwand (beispielsweise in einer Narbe nach Kaiserschnitt und im intramuralen Teil des Eileiters werden in der deutschen Übersetzung der ICD-10 als Extrauteringravidität bezeichnet, sind jedoch, streng genommen, intrauterine, aber ektope Schwangerschaften.[1]
Mit Ausnahme der Bauchhöhlenschwangerschaft ist eine Extrauteringravidität nicht überlebensfähig und damit austragbar. In der Regel stirbt der Embryo nach einigen Wochen durch eine Unterversorgung an Nährstoffen ab, da der Implantationsort keine optimalen Voraussetzungen bietet. Zudem stellt die Extrauteringravidität, auch die Bauchhöhlenschwangerschaft, eine Gefahrensituation für die Mutter dar, da es zu schweren, lebensbedrohlichen inneren Blutungen kommen kann.
Durch die verbesserten diagnostischen Möglichkeiten lassen sich extrauterine Schwangerschaften heute sehr früh erkennen. Besonders in Ländern mit schlechter Schwangerschaftsbetreuung sind Extrauteringraviditäten jedoch trotz der verbesserten Diagnostik eine bedeutende Ursache mütterlicher Morbidität und Mortalität.[2]
Die Behandlung einer Extrauteringravidität besteht üblicherweise in der operativen Entfernung der Schwangerschaft meist über eine Bauchspiegelung. Medikamentös wird seit etwa 20 Jahren auch Methotrexat in der Behandlung eingesetzt.
Inhaltsverzeichnis
Epidemiologie
Extrauteringraviditäten kommen in einer Häufigkeit von 1 bis 2 auf 100 intrauterine Schwangerschaften vor. In den meisten Fällen handelt es sich um eine Tubargravidität, die in 4/5 der Fälle im ampullären Teil des Eileiters lokalisiert ist.[3] 4 bis 9 % der schwangerschaftsbedingten Mortalität in entwickelten Staaten gehen auf extrauterine Schwangerschaften zurück.[4][2] Die Fertilitätsrate nach Extrauteringravidität beträgt durchschnittlich etwa 55 %. Es besteht jedoch ein Rezidivrisiko von ca. 15 %.[3]
EUG-Häufigkeit in Abhängigkeit vom Alter[1] Alter (Jahre) Inzidenzrate (%) < 20 0,4 20-30 0,7 30-40 1,3 - 2,0 In den letzten Jahren wurde parallel mit dem Anstieg von sexuell übertragenen Infektionen eine Zunahme der Extrauteringraviditäten verzeichnet.[1]
In den USA stieg die Zahl der Neuerkrankungen von 17.800 im Jahr 1970 (Inzidenzrate 4,5 je 1.000 Schwangerschaften) auf 88.400 im Jahr 1989 (16,0 je 1.000 Schwangerschaften).[5] Auch danach war ein weiterer Anstieg zu verzeichnen.[6] Die Mortalität an dieser Erkrankung ging jedoch zurück.[7]
Als Ursachen der gestiegenen Inzidenz wird, neben der Zunahme der genitalen Infektionserkrankungen, die vermehrte Anwendung der In-vitro-Fertilisation bei Frauen über 30 Jahren angesehen.[1]
Entstehung
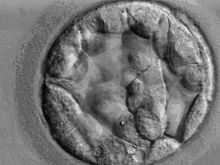
In einer normalen Schwangerschaft erreicht der Embryo im Stadium der Blastozyste zwischen dem 5. und 6. Tag nach der Befruchtung als die Gebärmutterhöhle und beginnt sich dort in die Gebärmutterschleimhaut einzunisten. Diesen Vorgang nennt man Nidation, oder Implantation. Etwa 1 % der Embryonen siedeln sich außerhalb der Gebärmutterhöhle an.
Bei einer typischen Extrauteringravidität heftet sich der Embryo an die Eileiterschleimhaut an und wächst in die Schleimhaut hinein. Dadurch kommt es zur Eröffnung von Blutgefäßen mit einer Blutung. Dadurch füllt sich der Eileiter mit Blut, der dann als Hämatosalpinx bezeichnet wird. Das Blut kann zum Herausdrücken der Schwangerschaft aus dem Eileiter führen, was als Tubarabort bezeichnet wird. Bei der Extrauteringravidität spielt eine Entzündung keine Rolle. Der Schmerz wird durch Prostaglandine, die an der Implantationsstelle freigesetzt werden, oder freies Blut in der Bauchhöhle, welches das Bauchfell reizt, hervorgerufen. Diese Blutung kann zuweilen so stark sein, dass sie das Leben der Frau gefährdet. Ein solches Blutungsausmaß ist meist durch eine Verzögerung der Diagnostik bedingt. Sie kann jedoch auch früher auftreten, wenn die Implantation im Eileiter nahe der Gebärmutter erfolgt ist. Dieses kann zu erheblichen Blutungen aus dem Ramus uterinus der Arteria ovarica, einer Verbindung zur Arteria uterina, im angloamerikanischen Sprachraum auch als Sampson-Arterie bekannt, führen.
Ursachen
Es gibt eine ganze Reihe von Risikofaktoren für eine Extrauteringravidität. Jedoch lassen sich in einem Dritte[8] bis zur Hälfte[9] der Fälle keine Risikofaktoren nachweisen. Zu den Risikofaktoren zählen entzündlich-bedingte Erkrankungen im Beckenbereich (Pelvic Inflammatory Disease), Infertilität, die Nutzung von Intrauterinpessaren, eine frühere Exposition mit Diethylstilbestrol, Tubenchirurgie, intrauterine Eingriffe (Ausschabungen), Rauchen, frühere ektope Schwangerschaft und eine Sterilisationen.[10]
In den letzten Jahren wurde parallel mit dem Besorgnis erregenden Anstieg von sexuell übertragenen Infektionen eine Zunahme der Extrauteringraviditäten verzeichnet. Allerdings dürften dabei sowohl die gestiegene Früherkennung als auch die häufiger durchgeführte intrauterine Kontrazeption (Empfängnisverhütung) mittels Spirale eine wesentliche Rolle spielen. So ist in den USA in den letzten 30 Jahren die Anzahl der Neuerkrankungen um das Dreifache gestiegen. Die Extrauteringravidität ist dort der häufigste Grund für Todesfälle in den ersten drei Schwangerschaftsmonaten und die vierthäufigste Mortalitätsursache in der gesamten Schwangerschaft.
Obwohl frühere Publikationen eine Verbindung zwischen Endometriose und ektopen Schwangerschaften vermuteten, ließ sich dies nicht nachweisen.[11]
Eileiterschädigung
Die Flimmerhärchen der Eileiterschleimhaut transportiert die befruchtete Eizelle, die sich dabei durch Teilung zum Embryo entwickelt, zur Gebärmutter. Die Zahl der Zilien war bei Eileiterschwangerschaften zuweilen reduziert, was zur Hypothese eines Zilienschadens führte, der für ektope Schwangerschaften verantwortlich ist.[12]
Frauen mit entzündlich-bedingten Veränderungen im Becken (Pelvic Inflammatory Disease) haben häufiger eine ektope Schwangerschaften.[13] Dies resultiert aus der Ausbildung von Narbengewebe in den Eileitern, welches die Flimmerhärchen zerstört.[14] Bei einem vollständigen Verschluss beider Eileiter sind Spermien und Eizelle nicht in der Lage, zusammenzutreffen, so dass eine Befruchtung der Eizelle nicht möglich ist, und daher keine Schwangerschaft eintritt. Chirurgische Maßnahmen an den verschlossenen Eileitern haben das Ziel, diese wieder zu eröffnen. Damit wird jedoch der natürliche Schutz aufgehoben und das Risiko einer ektopen Schwangerschaft steigt. Intrauterine Verwachsungen wie beim Asherman-Syndrom können einerseits eine Zervixschwangerschaft verursachen. Verhindern diese Verwachsungen teilweise den Zugang zum Eileiter, kann es andererseits aber auch zu einer Eileiterschwangerschaft kommen.[15][16][17] Das Asherman-Syndrom kann durch intrauterine Eingriffe, wie Kürettagen verursacht werden.[15] Auch eine urogenitale Tuberkulose kann Ursache eines Asherman-Syndroms sein. Zusätzlich entstehen dabei zusätzlich Verwachsungen der Eileiter, die ebenfalls zu einer Extrauteringravidität führen können.[18]
Auch eine Sterilisation kann das Risiko einer Extrauteringravidität erhöhen. 70 % aller Schwangerschaften nach Verödung der Eileiter sind ektope Schwangerschaften, während 70 % der Schwangerschaften nach Eileiterverschluss durch einen Clip intrauterin zu finden sind. Eine Refertilisierung nach Sterilisation birgt ebenfalls das Risiko einer ektopen Schwangerschaft. Dieses ist höher, wenn stärker destruierende Verfahren, wie die Koagulation oder eine Teilentfernung der Eileiter gewählt wurden, als bei weniger destruktiven Methoden, wie dem Clipping. Eine frühere Eileiterschwangerschaft erhöht das Risiko einer erneuten Eileiterschwangerschaft auf 10 %[14] Dieses Risiko verringert sich auch nicht, wenn der betroffene Eileiter entfernt wurde und der andere unauffällig schien.
andere Ursachen
Obwohl einige Untersuchungen ein höheres Risiko mit zunehmendem Alter zeigten, wird angenommen, dass das Alter eher einen Surrogatmarker für andere Risikofaktoren darstellt. Auch das Tabakrauchen ist mit einem höheren Risiko für Extrauteringraviditäten verbunden.[14]
Frauen, die intrauterin Diethylstilbestrol (DES) ausgesetzt waren, haben ein bis zu dreifach erhöhtes Risiko im Vergleich zu Frauen ohne diese Exposition. Es wurde auch vermutet, dass eine krankhaft vermehrte Bildung von Stickstoffmonoxid, durch erhöhte i-Stickstoffmonoxid-Synthase-Aktivität (iNOS), die Schlagzahl der Flimmerhärchen und die Kontraktion der glatten Muskelzellen reduziert, damit den Embryotransport beinträchtigt und dadurch zu einer ektopen Schwangerschaft führt.[19]
Klassifikation
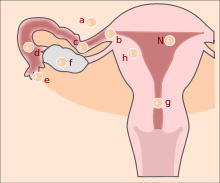 Formen der Extrauteringravidität
Formen der Extrauteringravidität
N normale Einnistung (Nidation)
a Bauchhöhlenschwangerschaft
b interstitielle oder cornuale Eileiterschwangerschaft
c isthmische Eileiterschwangerschaft
d ampulläre Eileiterschwangerschaft
e infundibuläre Eileiterschwangerschaft
f Ovarschwangerschaft
g Zervixschwangerschaft
h intramurale SchwangerschaftTubargravidität
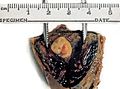
Die Mehrheit der Extrauteringraviditäten finden sich in einem der beiden Eileiter. Die Schwangerschaft kann sich fimbrientrichternah (infundibulär) (5 % aller EUG), im ampullaren Teil (80 %), im Isthmus (12 %) und im cornualen oder interstitiellen Teil des Eileiters (2 %).[14] Die Mortalität einer isthmischen oder interstitiellen Eileiterschwangerschaft ist höher, da es bei stärkerer Gefäßversorgung (Vascularisierung) häufiger zu starken inneren Blutungen kommt. Ein Review aus dem Jahr 2010 unterstützt die Hypothese, dass Eileiterschwangerschaften durch einen gestörten embryo-tubaren Transport und Veränderungen in der Eileiterumgebung verursacht werden, so dass es zu einer frühen Implantation kommt.[20]
Nichttubare Extrauteringravidität
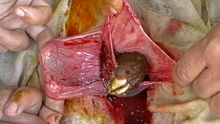
Zwei Prozent der ektopen Schwangerschaften entstehen im Eierstock, dem Gebärmutterhals oder in der Bauchhöhle. Mit der transvaginalen Ultraschalluntersuchung lassen sich Zervixschwangerschaften üblicherweise erkennen. Eine Ovarschwangerschaft lässt sich von einer Eileitzerschwangerschaft durch die Spiegelberg-Kriterien, benannt nach dem deutschen Gynäkologen Otto Spiegelberg (1830-1881), unterscheiden.[21][22] Danach besteht der Verdacht auf eine Ovarschwangerschaft, wenn sich
- der Fruchtsack im Eierstock befindet
- die ektope Schwangerschaft durch das Lig. ovarii proprium an die Gebärmutter herangezogen ist
- Eierstockgewebe in der Wand des Fruchtsacks histologisch nachgewiesen werden kann
- der Eileiter der betroffenen Seite intakt ist.
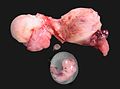
Obwohl eine ektope Schwangerschaft üblicherweise nicht überlebensfähig ist, gibt es in sehr seltenen Fällen Lebendgeburten bei Bauchhöhlenschwangerschaften. In diesen Fällen sitzt die Plazenta auf Bauchorganen oder dem Bauchfell und wurde ausreichend mit Blut versorgt. Dies ist üblicherweise am Darm und Mesenterium der Fall. Es wurde aber auch von anderen Lokalisationen, wie nahe der Nieren-, Leberarterie oder der Aorta berichtet. Die Feten müssen in diesen Fällen durch Laparotomie geboren werden. Dabei ist die mütterliche Morbidität und Mortalität hoch, da die Entfernung der Plazenta meist zu unkontrollierbaren Blutungen führt. Aus diesem Grund werden beispielsweise Darmsegmente zusammen mit der Plazenta entfernt.[23][24][25] Allerdings müssen die meisten Bauchhöhlenschwangerschaften aufgrund des hohen Blutungsrisikos deutlich vor der Überlebensfähigkeit des Feten entfernt werden.
Heterotope Schwangerschaft
In seltenen Fällen kommt es durch die Befruchtung zweier Eizellen zu einer gleichzeitigen intrauterinen und einer ektopen Schwangerschaft. Dies wird heterotope Schwangerschaft genannt. Dabei wird aufgrund der auftretenden Beschwerden häufig die intrauterine Schwangerschaft erst nach der ektopen entdeckt. Da eine Extrauteringravidität frühzeitig operativ entfernt wird, ist die intrauterine Schwangerschaft im Ultraschall häufig noch nicht darstellbar. Bei nach der Operation steigenden hCG-Werten besteht die Möglichkeit einer sich noch entwickelnden normalen Schwangerschaft.
Obwohl heterotope Schwangerschaften sehr selten sind, steigt deren Häufigkeit an. Dies wird auch durch die zunehmende Anwendung der IVF verursacht. Die Überlebensrate des intrauterinen Embryos beträgt etwa 70 %.[26]
Es wurden auch erfolgreiche Schwangerschaften nach rupturiertem Eileiter berichtet, wenn sich die Plazenta auf Bauchorganen oder der Gebärmutteraußenwand ansiedelt.
Persistierende Extrauteringravidität
Von einer persistierenden Extrauteringravidität spricht man, wenn nach der organerhaltenden Entfernung der ektopen Schwangerschaft Trophoblastanteile fortbestehen. Bei 15 bis 20 % der Frauen kommt es nach einer slchen Operation zu einem erneuten Wachstum von Trophoblastgewebe, welches teilweise in tieferen Eileiterschichten eingebettet ist. Es bildet neues hCG und kann nach Wochen zu erneuten klinischen Symptomen, wie Blutungen, führen. [27]Daher werden nach ektopen Schwangerschaften die Serum-hCG-Werte kontrolliert, um deren Absinken zu beobachten. Es ist zudem möglich zeitgleich zur Operation Methotrexat zu verabreichen.
Symptomatik
Frühe Symptome können bei einer Extrauteringravidität sehr milde sein oder gänzlich fehlen. Klinisch zeigt sich eine ektope Schwangerschaft zwischen der 5. und 8. Woche nach Beginn der letzten Menstruationsblutung (durchschnittlich nach 7,2 Wochen). Stehen moderne diagnostische Möglichkeiten nicht zur Verfügung, kommt es häufiger erst zu späteren Entdeckungen einer Extrauteringravidität.
Mögliche Symptome bei einer Extrauteringravidität können sein:
- Übelkeit, Erbrechen
- Brustspannen
- häufiger Harndrang und Dysurie
- Unterbauchschmerzen (meist auf der Seite einer Eileiterschwangerschaft)
- ausbleibende Periode
- vaginale Blutung, meist von geringer Stärke, die eine Unterscheidung zu einer gestörten Frühschwangerschaft, einer Nidationsblutung oder auch einer normalen Schwangerschaft erschwert
Im weiteren Verlauf kommt meist es zu stärkeren Schmerzen aufgrund der inneren Blutungen und zu vaginalen Blutungen durch fallende Progesteron-Spiegel. Da Entzündungen im Beckenbereich bei einer Schwangerschaft extrem selten auftreten, kann bei positivem Schwangerschaftstest eine Adnexitis nahezu ausgeschlossen werden. Eine Extrauteringravidität kann zudem Symptome verursachen, wie man sie auch bei der Appendizitis, Erkrankungen der Harnwege oder des Magen-Darm-Trakts findet.
Diagnosestellung
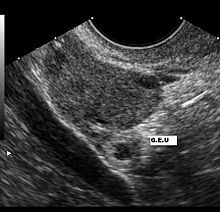
Eine Extrauteringravidität muss bei jeder Frau mit Bauchschmerzen oder vaginaler Blutung bei positivem Schwangerschafsttest angenommen werden. Eine Ultraschalluntersuchung, die außerhalb der Gebärmutter einen Fruchtsack mit fetalen Anteilen und Herzaktionen zeigt, ist beweisend für eine Extrauteringravidität.
Ein zu geringer Anstieg des β-hCG im Serum kann ebenfalls ein Hinweis auf eine ektope Schwangerschaft sein. Ab einem β-hCG-Wert von etwa 1500 IU/ml ist eine normale intrauterine Schwangerschaft im Ultraschall mit hoher Wahrscheinlichkeit darstellbar. Zeigt eine hochauflösende transvaginale Sonografie bei einem solchen Wert keine intrauterine Schwangerschaft, muss eine Extrauteringravidität in Betracht gezogen werden.
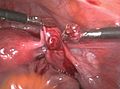
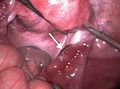
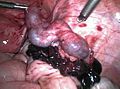
Mittels einer Bauchspiegelung oder Laparotomie lässt sich eine ektope Schwangerschaft visuell darstellen. Dabei kann es nach Tubarabort oder Tubarruptur schwierig sein, das Schwangerschaftsgewebe zu finden. Eine Bauchspiegelung in einer frühen Schwangerschaftswoche kann trotz Eileiterschwangerschaft einen normalen Befund bieten.
Durch eine Punktion des Douglas-Raums (Kuldozentese) wurde früher eine intrabdominale Blutung nachgwiesen. Das Cullen-Zeichen kann ebenfalls eine rupturierte Eileiterschwangerschaft mit Blutungen in den Bauchraum anzeigen.
Behandlung
Chirurgische Therapie
Bei eingetretener Blutunge oder nachgewiesener Herzaktion ist eine chirurgische Behandlung notwendig. Mittels Bauchspiegelung oder per Bauchschnitt kann dann die Schwangerschaft entfernt werden. Dazu ist bei einer Eileiterschwangerschaft häufig eine Eröffnung des Eileiters (Salpingotomie) mit Erhalt des Eileiters erforderlich. Alternativ kann auch der Eileiter komplett entfernt werden (Salpingektomie).[28]
Medikamentöse Therapie
Eine frühe ektope Schwangerschaft kann seit 1993 auch durch die systemische oder lokale Gabe von Methotrexat behandelt werden.[29][30] Das Medikament, ein Zytostatikum, hemmt das Wachstum des Embryos und verursacht einen Abort, welcher dann in der Bauchhöhle resorbiert oder vaginal ausgestoßen wird. Kontraindikationen sind Leber-, Nieren-, oder Bluterkrankungen, sowie eine ektope Schwangerschaft von > 3,5 cm.
Mögliche Komplikationen
Die häufigste Komplikation einer Extrauteringravidität sind innere Blutungen, die zum hypovolämischen Schock führen. Die Sterblichkeit ist jedoch gering, wenn ein Zugang zu moderner medizinischer Versorgung besteht.
Prognose
Die Fertilität nach Extrauteringravidität hängt von mehreren Faktoren ab. Der wichtigste Faktor ist dabei ein unerfüllter Kinderwunsch in der Vergangenheit.[31] Auch die Wahl der Behandlung spielt eine Rolle. So ist die Rate an intrauterinen Folgeschwangerschaften nach Methotrexat-Behandlung höher als nach chirurgischer Therapie.[32] Die Chancen für eine Schwangerschaft sind nach Erhalt des Eileiters besser als nach Entfernung desselben.[32]
Lebendgeburten
Wiederholt wurde über Lebendgeburten bei Bauchhöhlenschwangerschaften berichtet, die durch Bauchschnitt (Laparotomie) geboren wurden.
- 1986 wurde in Deutschland unter dem Verdacht auf eine Uterusruptur ein Bauchschnitt durchgeführt und dabei eine Bauchhöhlenschwangerschaft am Termin entwickelt.[33]
- 1999 wurde in Ogden (Utah), in den USA ein gesundes Mädchen geboren, das sich außerhalb der Gebärmutter entwickelt hatte, was bei geburtshilflicher Sonografie nicht erkannt worden war. Erst bei einem Kaiserschnitt wurde die Lokalisation der Schwangerschaft festgestellt.[34][35]
- Ebenfalls 1999 wurde eine 32-jährige britische Frau von Drillingen entbunden. Dabei hatten sich zwei Kinder in der Gebärmutter entwickelt und das dritte nach Ruptur des Eileiters in der Bauchhöhle.[36]
- 2008 wurde bei einer britischen 37-jährigen Frau eine Schwangerschaft am Omentum majus festgestellt. Das Kind wurde in der 28. Schwangerschaftswoche geboren. Mutter und Kind überlebten.[37]
- 2008 fand man bei einer 34-jährigen australischen Frau in der 38. Schwangerschaftswoche eine Ovarschwangerschaft. Das Mädchen wog 2.800 g und war gesund.[38][39]
- 2011 wurde eine 23-jährige Frau in Saudi-Arabien am Geburtstermin von einem gesunden Kind entbunden. Bei einem Kaiserschnitt wegen Beckenendlage fand sich eine Bauchhöhlenschwangerschaft. Bei den Ultraschalluntersuchungen in der Schwangerschaft war der Verdacht auf einen Uterus bicornis, einer Fehlbildung der Gebärmutter, geäußert worden. Zudem hatte die Frau in der Schwangerschaft über Beschwerden im Unterbauch berichtet.[40]
2008 wurden jedoch in einer Publikation 163 Fälle fortgeschrittener Bauchhöhlenschwangerschaften seit 1946 analysiert. Dabei fand sich eine um 19 % höhere Inzidenz in nicht-industrialisierten Ländern. In nur 45 % der beschriebenen Fälle wurde die Diagnose vor der Operation korrekt gestellt. 72 % der Feten und 12 % der Mütter verstarben.[41]
Veterinärmedizin
Extrauteringraviditäten kommen auch bei anderen Säugetieren , insbesondere allen Haustieren, vor. Dabei sind ektope Schwangerschaften bei Rindern am häufigsten anzutreffen.
Während beim Menschen überwiegend primäre Extrauteringraviditäten auftreten, sich die Schwangerschaft gleich an der falschen Stelle eingenistet hat, handelt es sich bei Tieren meist um sekundäre ektope Schwangerschaften. Dabei gelangt ein Embryo oder Fetus aus der Gebärmutter heraus und nistet sich an anderer Stelle, meist in der freien Bauchhöhle, wieder ein.
Ovargraviditäten sind im Tierreich bislang nicht beschrieben. Eileiterschwangerschaften haben in der Veterinärmedizin ebenfalls keine Bedutung.[42]
Geschichte
Die Erstbeschreibung einer Extrauteringravidität im Jahr 963 wird Albucasis (936-1013) zugeschrieben. Er berichtete über eine Patientin mit einer Schwellung des Bauches, aus dem Eiter über die Bauchdecke abfloss, in dem sich ein menschliches Skelett fand. Jacob Noierus führte 1591 und 1596 erste chirurgische Eingriffe bei ektoper Schwangerschaft durch, bei denen er durch einen Bauchschnitt den Feten lediglich herauszog.[43] Der Franzose Jean Riolan aus Paris berichtete 1604 zuerst über eine rupturierte Eileiterschwangerschaft. Die Patientin war im 4. Monat ihrer achten Schwangerschaft einen Tage nach dem Beginn der Symptomatik verstorben. [43]
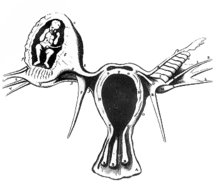 Darstellung einer Tubargravidität von Reinier de Graaf aus dem Jahr 1672
Darstellung einer Tubargravidität von Reinier de Graaf aus dem Jahr 1672
1672 veröffentlichte Reinier de Graaf in seinem Werk De mulierum organis in generationi inservientibus tractatus novus. eine bildliche Darstellung nach einer Arbeit des französischen Chirurgen Benoit Vassal über Obduktionsbefunde bei einer 32-jährigen Frau, die bereits elf Kinder geboren hatte und am 6. Januar 1669 an einer Blutung bei einer Eileiterschwangerschaft verstorben war.[44][45] 1693 wurde von Bussière aus Paris eine unrupturierte Eileiterschwangerschaft bei der Obduktion einer exekutierten jungen Frau gefunden. Die erste Ovarschwangerschaft beschrieb der französische Arzt de Saint Maurice aus dem Périgord 1682. Auch bei dieser Frau wurde die Diagnose erst nach dem Tode gestellt.[43]
Die erste erfolgreiche Operation bei einer EUG über einen Bauchschnitt führte der Amerikaner John Bard (1716-1799), der Vater des Geburtshelfers Samuel Bard (1742-1821), 1759 in New York durch. Er entfernte einen toten, aber reifen Feten bei einer 28-jährigen Frau, die den Eingriff überlebte.[46]
William Baynham (1749-1814) berichtete über zwei Fälle einer EUG, die er operativ behandelte. Dabei war eine bereits 5 Jahre zuvor eingetreten.[47]
Erfolgreich verlief auch die Entfernung einer ektopen Schwangerschaft über die Scheide 1816 durch John King aus South Carolina.[48]Bis zum Ende des 19. Jahrhunderts wurde die Diagnose durch das Tasten eines Tumors seitlich oder hinter der vergrößerten Gebärmutter, unsicheren Schwangerschaftszeichen, wie Magen- und Brustbeschwerden, Ausbleiben der Menstruation, der verstärkten Durchblutung der Scheide und dem Hin-und-Herschwingen (Ballotieren) des Tumorinhalts gestellt. Da man den ektopen Fetus als Ursache der Sterblichkeit ansah, war das primäre Behandlungsziel ein Abtöten desselben. Dies wurde durch Hungern, Einläufe und Aderlässe bei der Mutter, sowie die Anwendung von Strychnin, Elektrotherapie, Galvanotherapie und Injektion von Morphium in den Fruchtsack versucht.[49] Die Prognose war jedoch schlecht. Die Sterblichkeitsrate betrug 72 bis 99 %. Eine Extrauteringravidität war zu der Zeit eine der häufigsten Todesursachen von jungen Frauen.[43][50] Dies besserte sich erst mit Einführung der Eileiterentfernung (Salpingektomie) durch Robert Lawson Tait (1845-1899), der diese 1884 erstmalig durchführte.[51][52][53]
Der deutsche Gynäkologe Richard Frommel (1854-1912) setzte sich, im Gegensatz zu der damals geltenden Lehrmeinung, die abwartendes Verhalten empfahl, als einer der Ersten für eine sofortige operative Intervention bei der extrauterinen Schwangerschaft ein.[54][55]
Betrug die Sterblichkeit zwischen 1908 und 1920 noch 12,3 %[56] betrug, sank sie im Zeitraum von 1920 bis 1937 auf 11,7 % und betrug zwischen 1937 und 1947 nur noch 1,7 bis 2,7 %.[57] Dies war das Ergebnis der Einführung von Bluttransfusionen als Routineverfahren, des besseren Verständisses der Schockmechanismen, der verbesserten Betreuung nach Operationen, sowie der früheren Diagnosestellung durch vermehrten Einsatz der Kuldozentese und Schwangerschaftstests.[43]
Als weiteres diagnostisches Verfahren wurde am Anfang der 1960er Jahre die Kuldoskopie genutzt.[58] Die Idee der direkten Betrachtung der Bauchhöhle entstand jedoch schon um den Anfang des 20. Jahrhunderts. Schon 1901 hatte der russische Arzt D. O. Ott über eine Eröffnung des Douglas-Raums (Kuldotomie), Vaginalspiegel und einen Kopfspiegel Becken- und Bauchorgane darstellen können, was er Ventroskopie nannte[59]
Der Schwede Hans Christian Jacobaeus (1879-1937) beschrieb 1910 als Erster die Technik der Laparoskopie und nutzte diese vor allem zur Diagnostik bei Patienten mit Aszites und Lebererkrankungen.[60][61] 1929 entwickelte der Internist Hans Kalk (1895-1973) eine neuartiges Laparoskop.[62] Es ermöglichte eine exakte Diagnostik und Kalk erkannte bereits, dass sich „für die Laparoskopie in der Gynäkologie ein großes Indikationsgebiet sich eröffnen würde“[63], was sich nach der Einführung durch Hans Frangenheim bestätigte.[64][65]
1953 brach W. B. Stromme mit der Praxis der Entfernung des Eileiters, indem er den Eileiter zur Entfernung des Schwangerschaftsprodukts eröffnete und diesen dabei erhalten konnte.[66] Zwanzig Jahre später gelang H. I. Shapiro und D. H. Adler 1973 die laparoskopische Entfernung einer Eileiterschwangerschaft.[67]
Eine heute immer frühere Diagnostik ist durch deutlich verbesserte Schwangerschaftstests, die quantitative Bestimmung des β-hCG und die vaginale Ultraschalluntersuchung möglich geworden.[43]
Literatur
- Jürgen Hucke: Extrauteringravidität. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1997, ISBN 3804714803
- W. Pschyrembel, J. W. Dudenhausen: Praktische Geburtshilfe. 17. Auflage, Walther de Gruyter, Berlin 1991, ISBN 3110128810, S. 565 ff
- Peter Oppelt: Extrauteringravidität. In: Manfred Kaufmann, Serban D. Costa, Anton Scharl: Die Gynäkologie. Springer Verlag, 2. Auflage 2006, ISBN 3540256644, S. 286-301
- E. Kucera, R. Lehner, Peter Husslein: Extrauteringravidität. In: Henning Schneider, Peter Husslein, Karl Theo M. Schneider: Die Geburtshilfe. Springer Verlag, 3. Auflage 2006, ISBN 3540338969, S. 32-39
- Heinrich Schmidt-Matthiesen, Diethelm Wallwiener: Gynäkologie und Geburtshilfe. Schattauer Verlag, 2007, ISBN 379452618X, S. 179
Weblinks
- Eileiterschwangerschaft. Informationen der Arbeitsgemeinschaft Gynäkologische Endoskopie e. V. der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe
- Extrauteringravidität. auf DocCheck Flexikon
Einzelnachweise
- ↑ a b c d E. Kucera, R. Lehner, Peter Husslein: Extrauteringravidität. In: Henning Schneider, Peter Husslein, Karl Theo M. Schneider: Die Geburtshilfe. Springer Verlag, 3. Auflage 2006, ISBN 3540338969, S. 32-39
- ↑ a b WHO: Maternal and perinatal health. zuletzt aufgerufen am 9. November 2011
- ↑ a b J. Hucke, U. Füllers: Extrauterine Schwangerschaft. Gynäkologe 38 (2005), S. 535–552, doi:10.1007/s00129-005-1705-1
- ↑ J. Lermann, A. Müller, C. Schulze, S. Becker, A. Boosz, S. P. Renner, M. W. Beckmann: Die Extrauteringravidität. Frauenheilkunde up2date 3 (2009), S. 383-402, doi:10.1055/s-0029-1224626
- ↑ Surveillance for Ectopic Pregnancy - United States, 1970-1989. MMWR 42 (1993)(SS-6), S. 73-85, online
- ↑ B. Trabert, V. L. Holt, O. Yu, S. K. Van Den Eeden, D. Scholes: Population-based ectopic pregnancy trends, 1993-2007. Am J Prev Med 40 (2011), 556-60, PMID 21496755
- ↑ A. A. Creanga, C. K. Shapiro-Mendoza, C. L. Bish, S. Zane, C. J. Berg, W. M. Callaghan: Trends in ectopic pregnancy mortality in the United States: 1980-2007. Obstet Gynecol 117 (2011), 837-43, PMID 21422853
- ↑ C.M. Farquhar, Ectopic Pregnancy, Lancet 366 (2005), S. 583
- ↑ J Indian Med Assoc. 2007 Jun;105(6):308, 310, 312 passim
- ↑ BestBets: Risk Factors for Ectopic Pregnancy. Abgerufen am 7. November 2011.
- ↑ Int J Gynaecol Obstet. 2006 Feb;92(2):157-8. Epub 2005 Dec 20
- ↑ Lyons RA, Saridogan E, Djahanbakhch O: The reproductive significance of human Fallopian tube cilia. In: Hum Reprod Update.. 12, Nr. 4, 2006, S. 363–72. doi:10.1093/humupd/dml012. PMID 16565155.
- ↑ Tay JI, Moore J, Walker JJ: Ectopic pregnancy. In: West J Med.. 173, Nr. 2, 2000, S. 131–4. doi:10.1136/ewjm.173.2.131. PMID 10924442. Volltext bei PMC: 1071024.
- ↑ a b c d L. Speroff, R. H. Glass, N. G. Kase: Clinical Gynecological Endocrinology and Infertility. 6. Auflage (1999), Lippincott Williams & Wilkins, S. 1149 ff, ISBN 0-683-30379-1
- ↑ a b Schenker JG, Margalioth EJ.: Intra-uterine adhesions: an updated appraisal. In: Fertility and Sterility. 37, Nr. 5, 1982, S. 593–610.. PMID 6281085.
- ↑ Klyszejko C, Bogucki J, Klyszejko D, Ilnicki W, Donotek S, Kozma J.: Cervical pregnancy in Asherman’s syndrome [article in Polish].. In: Ginekol Pol. 58, Nr. 1, 1987, S. 46–8.. PMID 3583040.
- ↑ Dicker, D. Feldberg, D. Samuel, N. and Goldman, JA.: Etiology of cervical pregnancy. Association with abortion, pelvic pathology, IUDs and Asherman's syndrome.. In: J Reprod Med. 30, Nr. 1, 1985, S. 25–7. PMID 4038744.
- ↑ Bukulmez O., Yarali H., Gurgan T.: Total corporal synechiae due to tuberculosis carry a very poor prognosis following hysteroscopic synechialysis. In: Human Reproduction. 14, Nr. 8, 1999, S. 1960–1.. doi:10.1093/humrep/14.8.1960. PMID 10438408.
- ↑ Al-Azemi M, Refaat B, Amer S, Ola B, Chapman N, Ledger W: The expression of inducible nitric oxide synthase in the human fallopian tube during the menstrual cycle and in ectopic pregnancy. In: Fertil. Steril.. 94, Nr. 3, Mai 2009, S. 833–840. doi:10.1016/j.fertnstert.2009.04.020. PMID 19482272.
- ↑ J. L. Shaw, S. K. Dey, H. O. Critchley, A. W. Horne: Current knowledge of the aetiology of human tubal ectopic pregnancy. Hum Reprod Update 16 (2010), S. 432–44, PMID 20071358, doi:10.1093/humupd/dmp057
- ↑ F. Plotti, A. Di Giovanni, C. Oliva, F. Battaglia, G. Plotti: Bilateral ovarian pregnancy after intrauterine insemination and controlled ovarian stimulation. Fertil Steril 90 (2008), 2015.e3–5, PMID 18394622, doi:10.1016/j.fertnstert.2008.02.117
- ↑ Spiegelberg-Kriterien auf whonamedit.com
- ↑ 'Special' baby grew outside womb, BBC news. 30. August 2005. Abgerufen am 14. Juli 2006.
- ↑ Bowel baby born safely, BBC news. 9. März 2005. Abgerufen am 10. November 2006.
- ↑ Zhang J, Li F, Sheng Q: Full-term abdominal pregnancy: a case report and review of the literature. In: Gynecol. Obstet. Invest.. 65, Nr. 2, 2008, S. 139–41. doi:10.1159/000110015. PMID 17957101. Abgerufen am 7. November 2011.
- ↑ http://answers.google.com/answers/threadview?id=568935
- ↑ Kemmann E, Trout S, Garcia A: Can we predict patients at risk for persistent ectopic pregnancy after laparoscopic salpingotomy?. In: The Journal of the American Association of Gynecologic Laparoscopists. 1, Nr. 2, February 1994, S. 122–126. doi:10.1016/S1074-3804(05)80774-1. PMID 9050473. Abgerufen am January 22, 2010.
- ↑ eMedicine - Surgical Management of Ectopic Pregnancy: Article Excerpt by R Daniel Braun. Abgerufen am 17. September 2007.
- ↑ Mahboob U, Mazhar SB: Management of ectopic pregnancy: a two-year study. In: Journal of Ayub Medical College, Abbottabad: JAMC. 18, Nr. 4, 2006, S. 34–7. PMID 17591007.
- ↑ Clark L, Raymond S, Stanger J, Jackel G: Treatment of ectopic pregnancy with intraamniotic methotrexate—a case report. In: The Australian & New Zealand journal of obstetrics & gynaecology. 29, Nr. 1, 1989, S. 84–5. doi:10.1111/j.1479-828X.1989.tb02888.x. PMID 2562613.
- ↑ Togas Tulandi; Tan, S. L; Tan, Seang Lin; Tulandi, T.: Advances in Reproductive Endocrinology and Infertility: Current Trends and Developments, S. 240, Informa Healthcare 2002, ISBN 0-8247-0844-X (Zugriff am 21. Dezember 2009)
- ↑ a b Hurd, William W.; Falcone, Tommaso: Clinical reproductive medicine and surgery, S. 724, St. Louis, Mo: Mosby/Elsevier 2007, ISBN 0-323-03309-1
- ↑ Michael Böhme, Jürgen Nieder, Wolfgang Weise: Bauchhöhlenschwangerschaft am Termin mit lebendem Kind. Zentralbl Gynakol 108 (1986), S. 516-9, PMID 3727853
- ↑ Registry Reports (English). In: Volume XVI, Number 5, ARDMS The Ultrasound Choice, 1999. Abgerufen am 22. Juni 2011.
- ↑ Miracle baby (English), Utah News from KSL-TV. 5. August 1999. Abgerufen am 22. Juni 2011.
- ↑ Doctors hail 'miracle' baby. 10. September 2009. Abgerufen am 7. November 2011.
- ↑ Laura Collins: Miracle baby Billy grew outside his mother's womb, Daily Mail. 31. August 2008. Abgerufen am 3. September 2008.
- ↑ Baby Born After Rare Ovarian Pregnancy, Associated Press. 30. Mai 2008.
- ↑ Rebekah Cavanagh: Miracle baby may be a world first. 30. Mai 2008.
- ↑ Amal A Dahab, Rahma Aburass, Wasima Shawkat, Reem Babgi, Ola Essa, Razaz H Mujallid: Full-term extrauterine abdominal pregnancy: a case report. J Med Case Reports 5 (2011), S. 531, PMID 22040324, online (PDF-Dokument; 410 kB).
- ↑ D. Nkusu Nunyalulendho, E. M. Einterz: Advanced abdominal pregnancy: case report and review of 163 cases reported since 1946. Rural Remote Health 8 (2008), S. 1087, online
- ↑ Johannes Richter: Tiergeburtshilfe. Georg Thieme Verlag, 1993, ISBN 3489534166, S. 146
- ↑ a b c d e f S. Lurie: The history of the diagnosis and treatment of ectopic pregnancy: a medical adventure. Eur J Obstet Gynecol Reprod Biol 43 (1992), S. 1–7, PMID 1737602, online
- ↑ Toby E. Huff: Intellectual Curiosity and the Scientific Revolution: A Global Perspective. Cambridge University Press, 2010, ISBN 0521170524, S. 196
- ↑ Ectopic Pregnancy
- ↑ John Bard: A Case of Extra-Uterine Foetus. In: Medical Observations and Inquiries of the Society of Physicians of London Vol. 2 (1764), S. 369-72.
- ↑ Ira M. Rutkow: The History of Surgery in the United States, 1775-1900: Periodicals and pamphlets. Norman Publishing, 1992, ISBN 093040548X, S. 89
- ↑ John King: Analysis of the subject of extra-uterine foetation, and of the retroversion of the gravid uterus. Wright, Norwich 1818
- ↑ Marc A. Fritz, Leon Speroff: Clinical Gynecologic Endocrinology and Infertility. Lippincott, Williams & Wilkins, 2010, ISBN 0781779685, S. 1384
- ↑ J. S. Parry, H. C. Lea: Extrauterine pregnancy. Am J Obstet Gynecol 9 (1976), S. 169-70.
- ↑ Robert Lawson Tait: Five cases of extrauterine pregnancy operated upon at the time of rupture. Br Med J 1 (1884), S. 1250.
- ↑ Robert Lawson Tait: Pathology and treatment of extrauterine pregnancy. Br Med J 2 (1884), S. 317.
- ↑ Robert Lawson Tait: Lectures on ectopic pregnancy. Birmingham 1888, S. 23, 25.
- ↑ Historie der Universitätsfrauenklinik Erlangen
- ↑ Richard Frommel: Zur Therapie und Anatomie der Tubenschwangerschaft. Deutsch Arch Klin Med 42 (1888), S. 91-102
- ↑ P. Graffagnino: Ectopic pregnancy.' Am J Obstet Gynecol 4 (1922), S. 148-158.
- ↑ C. G. Collins, W. D. Beacham, D. W. Beacham: Ectopic pregnancy, mortaiity and morbidity factors. Am J Obstet Gynecol 57 (1949), S. 1144-1154.
- ↑ H. L. Riva, L. A. Kammeraad, P. S. Anderson: Ectopic pregnancy: report of 132 cases and comments on the role of the culdoscope in diagnosis. Obstet Gynecol 20 (1962), S.189-198.
- ↑ D. O. Ott: Ventroscopic illumination of the abdominal cavity in pregnancy. Z Akus i Zhensk Bolez 15 (1901), S. 7.
- ↑ Hans Christian Jacobaeus: Über die Möglichkeit die Zystoskopie bei Untersuchung seröser Höhlungen anzuwenden. Münch Med Wochenschr 57 (1910), S. 2090–2092.
- ↑ Hans Christian Jacobaeus: Kurze Übersicht über meine Erfahrungen mit der Laparoskopie. Münch Med Wochenschr 58 (1911), S. 2017.
- ↑ Hans Kalk: Erfahrungen mit der Laparoskopie (zugleich mit Beschreibung eines neuen Instrumentes). Z Klin Med 111 (1929), S. 303.
- ↑ Hans Kalk, Egmont Wildhirt: Lehrbuch und Atlas der Laparoskopie und Leberpunktion. Thieme, Stuttgart 1962.
- ↑ Hans Frangenheim: Die Bedeutung der Laparoskopie für die gynäkologische Diagnostik. Fortschr Med 76 (1958), S. 451-452.
- ↑ Hans Frangenheim: Die Laparoskopie und die Culdoskopie in der Gynäkologie. Thieme Verlag, Stuttgart, 1959
- ↑ W. B. Stromme: Salpingostomy for tubal pregnancy: Report of a successful case. Obstet Gynecol 1 (1953), S. 472-475.
- ↑ H. I. Shapiro, D. H. Adler: Excision of an ectopic pregnancy through the laparoscope. Am J Obstet Gynecol 117 (1973), S. 290-1, PMID 4269637.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Reproduktionsmedizin
- Krankheitsbild in Gynäkologie und Geburtshilfe
- Pränatalmedizin
Wikimedia Foundation.