- Thymol
-
Strukturformel 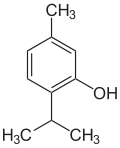
Allgemeines Name Thymol Andere Namen 2-Isopropyl-5-methyl-phenol,
2-(1-methylethyl)-5-methyl-phenolSummenformel C10H14O CAS-Nummer 89-83-8 PubChem 6989 Kurzbeschreibung farblose, würzig nach Thymian riechende, brennend schmeckende Platten[1]
Eigenschaften Molare Masse 150,22 g·mol−1 Aggregatzustand fest
Dichte 0,97 g·cm−3[2]
Schmelzpunkt Siedepunkt 233 °C[2]
Dampfdruck Löslichkeit - schlecht in Wasser (0,98 g·l−1) und Glycerin[1]
- gut in Natronlauge, Ethanol, Diethylether, Schwefelkohlenstoff und Chloroform[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 302-314-411 EUH: keine EUH-Sätze P: 273-301+330+331-305+351+338-309+310 [2] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 22-34-51/53 S: (1/2)-26-28-36/37/39-45-61 LD50 640 mg·kg−1 (Maus, oral) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Thymol ist ein Monoterpen und neben seinem Isomer Carvacrol ein Bestandteil der ätherischen Öle aus Ajowan, Thymian, Oregano und dem Bohnenkraut.
Inhaltsverzeichnis
Geschichte
Im alten Ägypten wurden Thymol und Carvacrol in Form von Thymianzubereitungen wegen der bakteriziden und fungiziden Eigenschaften zur Konservierung von Mumien benutzt.
Die kristalline Substanz Thymol wurde 1719 von Caspar Neumann entdeckt und von M. Lallemand im Jahre 1842 rein dargestellt und durch eine Elementaranalyse charakterisiert. Damit konnte er das richtige Verhältnis der Elemente Kohlenstoff, Wasserstoff und Sauerstoff bestimmen, die diese Substanz aufbauen. Auch Friedlieb Ferdinand Runge beschäftigte sich mit der Chemie dieser Substanz. Die Kristallstrukturanalyse mit der genauen Bestimmung der Atompositionen wurde erst 1980 von Alain Thozet und M. Perrin publiziert.
Gewinnung und Darstellung
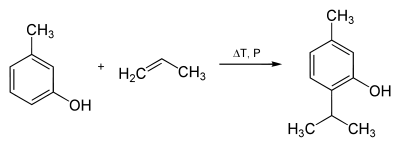
Thymol kann über die Reaktion von m-Kresol und Propen bei hohen Temperaturen und Druck hergestellt werden.[5]
Eigenschaften
Der Feststoff schmilzt bei 51,5 °C und siedet bei 233 °C. Die Dichte beträgt 0,97 g/cm³. Der Dampfdruck beträgt bei 65 °C 1,3 hPa. Der Flammpunkt liegt bei 104 °C.[2]
Da Thymol ein Phenolderivat ist, zeigt es das typische Verhalten von Phenol. Das heißt, es löst sich in Natronlauge oder Kalilauge und wird daraus durch Ansäuern wieder freigesetzt. Auch in Ethanol, Ether und Chloroform ist es gut löslich, in einem Liter Ethanol lösen sich bei 25 °C 1000 g Thymol, in einem Liter Chloroform etwa 1428 g Thymol. In Wasser ist es nur schwer löslich, in einem Liter Wasser löst sich etwa ein Gramm Thymol.
Thymol kann zu Menthol hydriert werden.
Die Bromierung von Thymol mit elementarem Brom in Essigsäure führt ausschließlich zum 4-Bromthymol.[6]
Verwendung
Thymol zeichnet sich durch eine starke desinfizierende fungizide und bakterizide Wirkung aus und wird wegen seines angenehmen Geschmacks in Mundwässern, Zahnpasta und in 5-prozentiger alkoholischer Lösung zur Hautdesinfektion beziehungsweise lokal gegen Hautpilze eingesetzt, wie zum Beispiel als Bestandteil von Vaginalkapseln oder zur Behandlung von Mundhöhlenpilz bei AIDS-Patienten. In der Veterinärmedizin wird Thymol ebenfalls seit vielen Jahren zur Behandlung von Hautpilzinfektionen, aber auch als Verdauungsförderer verwendet. In der Bienenpflege findet Thymol eine Anwendung als Wirkstoff gegen Milbenbefall (Varroose).
Aus Thymol leiten sich die Triphenylmethanfarbstoffe Thymolphthalein, Thymolblau und Bromthymolblau ab, die als pH-Indikatoren Verwendung finden.
Weblinks
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f Eintrag zu CAS-Nr. 89-83-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. April 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 89-83-8 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Thymol bei ChemIDplus.
- ↑ Patentschrift für die Synthese von Thymol.
- ↑ Abstracts of Papers, J. Chem. Soc 1894, 66(1), S. 19. Volltext
Kategorien:- Gesundheitsschädlicher Stoff
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Terpenalkohol
- Phenol
- Sekundärer Pflanzenstoff
Wikimedia Foundation.