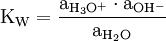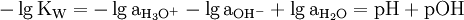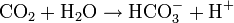- Ph-Wert
-
Der pH-Wert ist ein Maß für die Stärke der sauren bzw. basischen Wirkung einer wässrigen Lösung. Als logarithmische Größe ist er durch den mit −1 multiplizierten dekadischen Logarithmus (= „Zehnerlogarithmus“) der Oxoniumionenkonzentration (genauer: der Oxoniumionenaktivität) definiert. Der Begriff leitet sich von pondus Hydrogenii oder potentia Hydrogenii (lat. pondus = Gewicht; lat. potentia = Kraft; lat. hydrogenium = Wasserstoff) ab.
Inhaltsverzeichnis
Einteilung
Der dänische Chemiker Søren Sørensen führte den Begriff im Jahr 1909 für die Konzentration von Wasserstoffionen ein. Er definierte pH als den (Lösungs-)Druck p der Wasserstoffionen und indizierte das H für Wasserstoff.[1] In Anlehnung an die Dissoziationskonstante des Wassers kDiss = c (H+) · c(OH−) = 10−14 Mol2/Liter2 teilt man die Wertebereiche für reines Wasser und verdünnte wässrige Lösungen bei 22 °C ein in:
- pH < 7 entspricht einer Lösung mit saurer Wirkung
- pH = 7 entspricht absolut reinem Wasser oder einer neutralen Lösung
- pH > 7 entspricht einer alkalischen Lösung (basische Wirkung)
Messung des pH-Wertes
Der pH-Wert einer Lösung kann mit unterschiedlichen Methoden ermittelt werden:
Potentiometrie
Auf dem Prinzip der Potentiometrie beruhen die meisten handelsüblichen pH-Meter. Hierbei wird eine mit Pufferlösung gefüllte Glasmembrankugel in die zu messende Flüssigkeit eingetaucht. Durch die Neigung der Wasserstoffionen, sich in dünner Schicht an Silikatgruppen der Glasoberfläche anzulagern, baut sich je nach pH-Differenz eine galvanische Spannung zwischen der Innen- und der Außenseite der Kugel auf. Diese elektromotorische Kraft wird mittels zweier Bezugselektroden gemessen, von denen sich die eine innerhalb der Glaskugel, und die andere außerhalb in der Probelösung befindet. Mehr hierzu findet sich unter pH-Elektrode.
Messung durch Ionensensitive Feldeffekt-Transistoren
Ähnlich wie an der Glaselektrode bauen Wasserstoffionen an einer sensitiven Gate-Membran des ISFET ein Potential auf, welches die Stromdurchlässigkeit des Transistors beeinflusst. Durch geeignete Messtechnik lassen sich die Signale dann in pH-Werten anzeigen.
Bestimmung durch die Reaktion eines Indikatorfarbstoffes
Eine einfache Bestimmung des pH-Wertes erfolgt durch visuellen oder farbmetrische Bewertung der Farbumschläge von Indikatorfarbstoffen.
Durchschnittliche pH-Werte einiger gebräuchlicher Lösungen Substanz pH-Wert Art Batteriesäure <0 sauer Magensäure (nüchterner Magen) 1,0–1,5 Zitronensaft 2,4 Cola 2,0–3,0 Essig 2,5 Fruchtsaft der Schattenmorelle 2,7 Orangen- und Apfelsaft 3,5 Wein 4,0 Saure Milch 4,5 Bier 4,5–5,0 Saurer Regen < 5,0 Kaffee 5,0 Tee 5,5 Regen (natürlicher Niederschlag) 5,6 Mineralwasser 6,0 Milch 6,5 Wasser (je nach Härte) 6,0–8,5 sauer bis basisch Menschlicher Speichel 6,5–7,4 Blut 7,4 basisch Meerwasser 7,5–8,4 Pankreassaft (Darmsaft) 8,3 Seife 9,0–10,0 Haushalts-Ammoniak 11,5 Bleichmittel 12,5 Beton 12,6 Natronlauge 13,5–15 Die Auswertung erfolgt meist anhand von Farbvergleichsskalen. Dabei kann entweder der Farbumschlag eines einzelnen Farbstoffes für einen relativ engen Bereich der Messwerte ausgenutzt werden oder es kommen Farbstoffgemische, die sogenannten „Universalindikatoren“ zum Einsatz. >Diese zeigen über eine weite Skala von pH-Werten hinweg unterschiedliche Farben. Oft werden auf Messstreifen Felder mit verschiedenen Farbstoffen nebeneinander angeordnet, von denen jeder in einem anderen Wertebereich seine optimale Ablesbarkeit aufweist. Für spezielle Zwecke kann die Farbanzeige eines Indikatorfarbstoffs mit einem Photometer gemessen und so präziser ausgewertet werden.
Für die Farbgebung des Universalindikators werden verschiedene Stoffe verwendet, die sich bei jeweils unterschiedlichen pH-Werten verfärben. Solche pH-Idikatoren sind
- Lackmus: pH < 4,5 = Rot, pH > 8,3 = Blau
- Phenolphthalein: pH < 8,2 = Farblos, pH > 10,0 = Pink
- Methylorange pH < 3,1 = Rot, pH > 4,4 = Gelb
- Bromthymolblau: pH < 6,0 = Gelb, pH > 7,6 = Blau
Definition
Für sehr starke Säuren (pks-Wert<0) gilt:
Der pH-Wert ist der mit −1 multiplizierte dekadische Logarithmus der Aktivität der Oxoniumionen
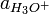 :
:Die Aktivität ist dabei in diesem Fall über das chemische Potenzial definiert und somit dimensionslos. Diese Definition des pH-Wertes wird bei einfachen Berechnungen jedoch selten verwendet. Vielmehr begnügt man sich aus Gründen der Vereinfachung mit der Näherung, dass die Oxoniumaktivität für verdünnte Lösungen gleich der Konzentration der Oxoniumionen (in mol / dm3) gesetzt wird:
Wie die Aktivitäten, ist somit auch der pH-Wert eine dimensionslose Größe.
pOH
Analog zum pH-Wert wurde ein pOH-Wert definiert. Dies ist der mit −1 multiplizierte dekadische Logarithmus der OH−-Aktivität. Die OH−-Aktivität ist in mol/dm³ einzusetzen.
Die beiden Werte hängen über das Autoprotolysegleichgewicht zusammen:
Der Logarithmus der Aktivität von Wasser ist etwa gleich null, da die Aktivität des Wassers für verdünnte Lösungen etwa gleich eins ist. Die Gleichgewichtskonstante ist unter normalen Bedingungen 10−14, der Zusammenhang zwischen pH und pOH-Wert ist also:
- pH + pOH = 14
Weitere Erläuterungen finden sich im Artikel Oxonium.
Der pH-Wert bei anderen Lösungsmitteln
Eine Maßzahl vergleichbar dem „pH-Wert“ ist auch für andere protische Lösungsmittel, die Protonen übertragen können, definiert. Auch dies beruht auf der Autoprotolyse dieser Lösungsmittel. Die allgemeine Reaktion lautet:
2LH
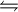 LH2+ + L− (allg. Formulierung der Autoprotolyse)
LH2+ + L− (allg. Formulierung der Autoprotolyse)- LH2+ = Lyonium-Ion
- L− = Lyat-Ion
Die Gleichgewichtskonstante K ist hier im allgemeinen kleiner als beim Ionenprodukt des Wassers.
Der pH-Wert ist dann folgendermaßen definiert:
- pHp = -lg [LH2+]
Derzeit liegt der niedrigste natürlich je gemessene pH-Wert bei -3,6 in einem Gemisch von Eisensulfat und Schwefelsäure in einem Pyritbergwerk in Kalifornien[2].
Einige Beispiele für die Autoprotolyse (wasserfreie) Ameisensäure 2HCOOH 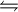 HCOOH2+ + HCOO−
HCOOH2+ + HCOO−Ammoniak 2NH3 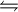 NH2− + NH4+
NH2− + NH4+Eisessig 2CH3COOH 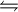 CH3COO− + CH3COOH2+
CH3COO− + CH3COOH2+Ethanol 2C2H5OH 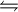 C2H5OH2+ + C2H5O−
C2H5OH2+ + C2H5O−pH und Säuren und Basen
Werden Säuren in Wasser gelöst, geben diese durch die Dissoziation Wasserstoffionen an das Wasser ab, der pH-Wert sinkt. Werden Basen gelöst, geben diese Hydroxylionen ab, die Wasserstoffionen aus der Dissoziation des Wassers binden. Sie können auch selbst Wasserstoffionen binden, wie dies für Ammoniak → Ammonium gilt. Mithin erhöhen Basen den pH-Wert. Der pH-Wert ist ein Maß der Menge an Säuren und Basen in einer Lösung. Je nach Stärke dissoziiert die Säure oder Base zu einem mehr oder weniger großen Anteil und beeinflusst somit den pH-Wert unterschiedlich stark.
In den meisten wässrigen Lösungen liegen die pH-Werte zwischen 0 (stark sauer) und 14 (stark alkalisch). Dennoch können schon in 1-molaren Lösungen starker Säuren und Basen diese Grenzen um jeweils eine Einheit überschritten werden, also von −1 bis 15. Die pH-Skala wird nur begrenzt durch die Löslichkeiten von Säuren oder Basen in Wasser. Bei sehr hohen oder sehr niedrigen pH-Werten und in konzentrierten Salzlösungen sind nicht die Konzentrationen für den pH-Wert entscheidend, sondern die Aktivitäten der Ionen. Aktivitäten sind von den Ionenkonzentrationen nicht linear abhängig.
Die meisten pH-Elektroden verhalten sich im Messbereich zwischen 0 und 14 annähernd linear, also annähernd konstante Unterschieden im gemessenen Elektrodenpotential entsprechen gleichen Unterschieden im pH-Wert. Nach internationaler Konvention können pH-Werte nur in diesem Bereich direkt gemessen werden.
Gemischte Lösungen aus einer schwachen Säure mit einem ihrer Salze oder schwachen Basen mit ihren Salzen ergeben Pufferlösungen. Hierbei stellen sich Gleichgewichte nahezu konstanter pH-Werte ein, die nahe dem negativen logarithmierten Wert ihrer Säurekonstanten bzw. Basenkonstanten liegen. Der pH-Wert dieser Lösungen ändert sich bei Zugabe von starken Säuren oder Basen deutlich weniger als bei Zugabe dieser entsprechenden Säuren und Basen in reinem, salzfreiem, "ungepuffertem" Wasser. Diese Mischungen besitzen eine bestimmte Pufferkapazität, der Effekt besteht solange wie die Zugabemenge den Vorrat der verbrauchten Pufferkomponente nicht übersteigt.
Reines Wasser nimmt Kohlenstoffdioxid aus der Luft auf, je nach Temperatur etwa 0,3 bis 1 mg/l. So bildet sich Kohlensäure, die zu Hydrogencarbonat dissoziiert:
Bei „chemisch reinem Wasser“ stellt sich deshalb ein pH-Wert von knapp 5 ein. Eine starke Beeinflussung des pH-Werts durch geringste Spuren von Protonendonatoren oder Protonenakzeptoren von reinem, destillierten oder entionisierten Wasser mit einem rechnerischen pH-Wert nahe 7, sagt nichts über die Wirkung auf chemische Reaktionen oder biologische Lebewesen aus.
Berechnung des pH-Wertes bei bekannter Konzentration an Säuren und Basen
Der pH-Wert lässt sich bei bekannter Konzentration an Säuren und Basen in einer wässrigen Lösung auch berechnen. So entspricht der pH-Wert starker Säuren dem negativen dekadischen Logarithmus der Konzentration der Säure, da man davon ausgeht, dass die Konzentration der Säure der der Oxoniumionen entspricht und die Autoprotolyse des Wassers außer Acht lässt.
Der pH-Wert von schwachen Säuren ist näherungsweise die Hälfte der Differenz von pKS-Wert und dem dekadischen Logarithmus der Säurekonzentration:
![\mathrm{pH} = \frac{1}{2} \, \left( pK_s - \lg \left[ S \right] \, \mathrm{\frac{dm^3}{mol}} \right)](/pictures/dewiki/102/fa7c246b73875bb85d5ae674b890a73a.png)
[S]: Konzentration der schwachen Säure in mol/l.
Diese Berechnungen können für das Herstellen von Lösungen mit einem bestimmten pH-Wert sehr hilfreich sein.
Für Lösungen einer Säure entsprechd einer Base und ihrem entsprechenden Salz lässt sich der pH-Wert recht gut näherungsweise über die sogenannte Henderson-Hasselbalch-Gleichung berechnen.
Für mehrprotonige Säuren kann man nur den Wert für die erste Protolysestufe (näherungsweise) berechnen, also für den niedrigsten pKs-Wert. Die Dissoziation der zweiten Stufe ist meist deutlich geringer. Eine exakte Berechnung ist äußerst aufwendig, da es ein System aus gekoppelten Gleichgewichten ist. Die Oxoniumionen aus der ersten Protolysestufe nehmen Einfluss auf die zweite und umgekehrt.
Gleiches gilt für Gemische aus mehreren Säuren und/oder Basen. Eine exakte algebraische Lösung ist meist nicht mehr möglich, die Gleichungen sind numerisch über iterative Verfahren zu lösen. Bei sehr hohen Konzentrationen an Säuren oder Basen ist die Konzentration in mol/dm3 durch die Aktivität der Oxoniumionen zu ersetzen.
Temperaturabhängigkeit
pH-Werte verschiedener Lösungen sind temperaturabhängig.
Eine 1-molare Phenollösung hat bei einer Temperatur der Lösung von 30 °C einen pKS-Wert des Phenols als Phenyl-OH von 10. Die Lösung hat einen pH-Wert von etwa 4,5. Ändert sich die Temperatur, so treten drei gekoppelte Effekte auf. Der erste ist der weitaus wichtigste.
- Die Gleichgewichtskonstante K für die Dissoziation von Phenol nimmt mit steigender Temperatur zu, damit auch die Dissoziation der Säure. Vergrößert sich K sinkt also der pH-Wert, und umgekehrt.
- :
- Bei einer Temperaturabsenkung von 30 °C auf 20 °C hat Phenol eine geringere Löslichkeit in Wasser. Es lösen sich nur ca. 0,9 mol/l. So steigt der pH-Wert auf rund 4,55. Dieser Effekt spielt nur eine Rolle für Lösungen nahe der Löslichkeitssättigung.
- Bei einer Temperaturerhöhung vergrößert sich das Volumen der Lösung geringfügig und die die molare Konzentration an Phenol verringert sich (Mol pro Volumen). Somit steigt der pH-Wert differentiell. Analog sinkt der pH-Wert bei einer Temperaturerniedrigung.
Bedeutung des pH-Wertes
Auswirkungen des pH-Wertes in der Chemie
Manche chemische Verbindungen ändern ihre chemische Struktur in Abhängigkeit vom pH-Wert und damit unter Umständen auch ihre Farbe, wie dies für pH-Indikatoren etwa das Phenolphthalein von farblos zu rot erfolgt.
Bei vielenn Reaktionen spielen die Wasserstoffionen eine Rolle, direkt in wässrige Lösung oder als „Katalysator“. So beeinflusst der pH-Wert die Reaktionsgeschwindigkeit. Das Beispiel ist die Aushärtung von Aminoplasten.
Auswirkungen des pH-Wertes auf das Wachstum von Pflanzen
Grundsätzlich beeinflusst der pH-Wert des Bodens die Verfügbarkeit der Nährsalze, bei neutralem und alkalischem pH-Wert kann Eisenmangel entstehen. Extreme pH-Werte wie saurer Regen oder Verätzungen beeinflussen die Pflanzenorgane unmittelbar.
Für den Nährstoffhaushalt von Pflanzen ist neben Phosphor, Schwefel und Kali besonders Stickstoff von Bedeutung. Stickstoff wird in Form von wasserlöslichen Ammoniumionen (NH4+) oder häufiger als Nitrationen (NO3−) aufgenommen. Ammonium und Nitrat stehen in Böden mit einem pH-Wert von 7 im Gleichgewicht. Bei sauren Böden überwiegen die NH4+ Ionen, bei alkalischen Böden überwiegen die NO3− Ionen. Können Pflanze aufgrund der Durchlässigkeit der Wurzelmembranen nur NH4+ aufnehmen, ist sie auf saure Böden angewiesen, obligat acidophil (säureliebend). Beim Aufnehmen von Nitrat NO3−, kann sie nur auf basenreichen Böden wachsen (obligat basophil). Wenn sie jedoch sowohl Ammonium, als auch Nitrat aufnehmen kann, kann sie sowohl auf sauren als auch auf basenreichen Böden wachsen. In Mineraldüngern wird Ammoniumnitrat (NH4NO3) verwendet, ein Salz aus Ammonium- und Nitrat-Ionen.
Bei hohem oder niedrigem pH-Wert sind die Nährstoffe im Boden festgelegt, sie stehen den Pflanzen nur unzureichend zur Verfügung. Bei einem niedrigen pH-Wert werden Aluminium- oder Manganionen löslich und für Pflanzen in schädigenden Mengen zugänglich.
Siehe auch: Boden-pH, Kalkstet, Kalkhaltiger Boden, Bodenversauerung, Versauerung der Meere
Die Bedeutung des pH-Wertes beim Menschen
Der für den Menschen verträgliche Bereich des pH-Wert von Blut und Zellflüssigkeit ist beschränkt Der pH-Wert des Blutes wird durch ein komplexes Puffersystem von gelöstem Gas, Salzen und Proteinen, dem sogenannten Blutpuffer, eingestellt. Normal ist ein pH-Wert von 7,35-7,45 in arteriellem Blut. Der pH-Wert des Blutes wirkt auf das Hämoglobin. Je geringer der pH-Wert ist, desto weniger Sauerstoff kann dieses binden (Bohr-Effekt). Wird im Gewebe durch die Atmungs-Kohlensäure der pH-Wert des Blutes gesenkt, gibt deshalb das Hämoglobin Sauerstoff ab. Wird umgekehrt in der Lunge Kohlendioxid abgeatmet, so steigt dort der pH-Wert des Blutes und somit die Aufnahmefähigkeit des Hämoglobins für Sauerstoff.
Auch bei der menschlichen Fortpflanzung hat der pH-Wert eine entscheidende Bedeutung. Während das Scheidenmilieu zur Abwehr von Krankheitserregern sauer ist, hat das Sperma des Mannes einen basischen pH-Wert. Die beim Geschlechtsakt einsetzende Neutralisationsreaktion führt zu einem optimalen Milieu zur Bewegung der Spermien.
Die Haut des Menschen ist leicht sauer bei einem pH ≈ 5,5. Der Säuremantel ist ein Schutz vor Krankheitserregern. Seifen sind deutlich basisch und „trocknen“ die Haut aus, sie entfernen die Fettschicht und zerstören die Säureschicht. Heutige Waschlotionen aus einem Gemisch einer Trägersubstanz aus Wasser, Glyzerin, Natriumchlorid, Natriumthiosulfat, Natriumhydrogencarbonat, Distearate und einem geringen Anteil synthetischer Tenside sind mit ihrem pH-Wert um 5 eingestellt.
Bedeutung des pH-Wertes für Aquarien
In Aquarien erfordern Pflanzen und Fische einen optimalen pH-Wert. Die Lebewesen haben einen Toleranzbereich für den pH-Wert und können außerhalb dieses Bereichs nicht überleben. Meist sind Pflanzen im Aquarium pH-toleranter als Fische.
Richtwerte von Süßwasser-Aquarienfischen
- Saures Wasser (pH ≈ 6):
- Südamerikaner (Neon, Skalar, Diskus, L-Welse, etc.)
- Asiaten (Guaramis, Fadenfische, etc.)
- Neutrales Wasser (pH ≈ 7)
- Mittelamerikaner (Feuermaulbuntbarsch, etc.)
- Alkalisches Wasser (pH ≈ 8)
- Ostafrikanische Grabenseen (Buntbarsche aus dem Tanganjika- und Malawisee, etc.)
Gemäß der Trinkwasserverordnung darf das Trinkwasser aus der Leitung einen pH-Wert zwischen 6,5 und 9,5 aufweisen. Es kann sich daher empfehlen mit qualitativ einwandfreiem Quellwasser statt mit Trinkwasser zu füllen. Das Wasser kann mit handelsüblichen Chemikaliensets auf den gewünschten pH eingestellt werden.
Siehe auch
- Der SH-Wert (Säuregrad) erfasst alle sauren Bestandteile der Probe, während der pH-Wert nur die H3O + -Ionenkonzentration angibt.
- Das pH-Meter ist ein elektrochemisches Messgerät zur Bestimmung des pH-Werts.
- Für Supersäuren verwendet man die Hammettsche Aciditätsfunktion zur Bestimmung der Säurestärke.
Literatur
- R. P. Buck, S. Rondinini, A. K. Covington, u.a.: Measurement of pH. Definition, standards, and procedures (IUPAC Recommendations 2002) in Pure Appl. Chem. 74(11), 2169−2200 (2002); Faksimile.
Weblinks
- http://www.liv.ac.uk/buffers
- http://www.fundgrube.priv.at/index.jsp?file=/chemie/saeurenBasen.xml
- pH-Wert-Berechnungen mit voreingestellten Arbeitsblättern
Einzelnachweise
- ↑ Der pH-Wert wird 100 Jahre alt
- ↑ D. K. Nordstrom, C. N. Alpers, C. J. Ptacek, D. W. Blowes: Negative pH and Extremely Acidic Mine Waters from Iron Mountain, California. In: Environmental Science & Technology. 34, Nr. 2, 2000, S. 254 - 258. doi:10.1021/es990646v
Wikimedia Foundation.


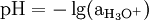
![\mathrm{pH = - \lg (a_{H_3O^+}) \approx - \lg \left( \frac{\left[ H_3O^+ \right]}{mol/dm^3}\right)}](/pictures/dewiki/97/aa7c79cf198cb63765d4e91ba7f3535b.png)