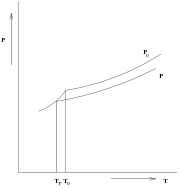
- Schmelzpunkterniedrigung
-
Gefrierpunktserniedrigung (oder auch Schmelzpunktserniedrigung) bezeichnet das Phänomen, dass der Schmelzpunkt von Lösungen niedriger liegt als der der reinen Flüssigkeiten.
Inhaltsverzeichnis
Definition
Die Gefrierpunktserniedrigung ΔT ist für verdünnte Lösungen proportional zur Molalität n der Teilchen des gelösten Stoffes:
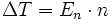
Dabei senkt sich der Gefrierpunkt pro Mol gelöstem Stoff pro Kilogramm Lösungsmittel um einen lösungsmittelspezifischen Wert. n ist dabei die Konzentration aller gelösten Teilchen des Stoffes in mol pro kg Lösungsmittel und nicht die Ausgangskonzentration des Stoffes. En ist die kryoskopische Konstante, die nur vom Lösungsmittel und nicht vom gelösten Stoff abhängt (bei Wasser ist dieser Wert 1,86 (K·kg)/mol). Sie lässt sich aus dem Raoultschen Gesetz und der Clausius-Clapeyronschen Gleichung ableiten zu
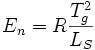 ,
,wobei
- R die Gaskonstante = 8,314472 J/(mol·K),
- Tg der Gefrierpunkt des Lösungsmittels in K und
- LS die spezifische Schmelzwärme des Lösungsmittels in J/kg
ist. Diese Beziehung gilt nur für stark verdünnte Lösungen (Konzentrationen <0,1 mol/L), bei höher konzentrierten Lösungen ist die Aktivität der Ionen und des Wassers zu beachten. Sehr stark konzentrierte Lösungen haben auch einen Tripelpunkt, bei der die Salzlösung gefriert, vorher friert nur Wasser aus der Lösung aus, die Lösung wird immer weiter aufkonzentriert.
Da der Gefrierpunkt jeweils genau um 1,86 K sinkt, wenn man ein Mol Teilchen in einem Kilogramm Wasser löst, wird die dazugehörige Temperaturdifferenz auch molare Gefrierpunktserniedrigung genannt. Dieser Effekt ist unabhängig von der Art des gelösten Stoffs, es handelt sich um eine kolligative Eigenschaft.
Bei der Berechnung der Teilchenkonzentration ist zu beachten, dass Salze in wässriger Lösung dissoziieren. Kochsalz (NaCl) zerfällt z. B. in die Ionen Na+ und Cl-. Aus einer 1 mol Natriumchlorid entstehen also 2 mol Teilchen und dieser Wert ist für die Berechnung von n in oben angeführter Gleichung zu berücksichtigen.
Ebenso von der Molalität bzw. von der Konzentration der gelösten Stoffe abhängig ist der Siedepunkt. Man spricht von Molarer Siedepunkterhöhung. Ursache für diese Effekte ist eine Erniedrigung des chemischen Potenzials der Lösung gegenüber dem reinen Lösungsmittel durch die Mischungsentropie.
Beispiele
Einige Beispiele Stoff Schmelzpunkt in °C Gefrierpunktserniedrigung
in (K · kg) / molWasser 0 -1,86 Naphthalin 80,2 -6,80 Chloroform -63,5 -4,68 Benzol 5,5 -5,12 Campher 179 -39,7 Ethanol -114,6 -1,99 Cyclohexan 6,4 -20,2 Hintergrund
Neben der Siedepunkterhöhung ist die Gefrierpunktserniedrigung eine weitere Folge, die mit dem verringerten Dampfdruck von Lösungen zusammenhängt.
Steht ein flüssiges Gemisch aus dem festen Stoff A und dem Lösungsmittel B im Gleichgewicht mit dem festem Stoff A, so ergibt sich der Ansatz μA,l = μA,s (mit μ als Chemisches Potential). Es gilt weiterhin dμA,l = dμA,s.
Hierbei bezeichnet der Index l die flüssige Phase, während s die feste Phase kennzeichnet. Aus obiger Gleichung lassen sich die totalen Differentiale aufstellen:
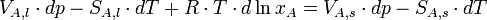
wobei
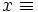 der Molenbruch des gelösten Stoffes im Lösungsmittel ist. Arbeitet man bei konstantem Druck, nimmt die Gleichung die stark vereinfachte folgende Form an:
der Molenbruch des gelösten Stoffes im Lösungsmittel ist. Arbeitet man bei konstantem Druck, nimmt die Gleichung die stark vereinfachte folgende Form an: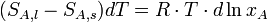
Die Differenz der n des festen und des flüssigen Zustandes (SA,l − SA,s) entspricht der molaren Schmelzentropie der Substanz A. Diese Größe lässt sich als ΔHSchm./TSchm. beschreiben.
Als TSchm. wird die Schmelzpunkttemperatur der reinen festen Phase bezeichnet. Setzt man diesen Zusammenhang in die obige Gleichung ein und integriert zwischen den Grenzen der Temperaturen TSchm. und T bzw. 1 und dem Molenbruch xA, so ergibt sich:
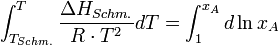
![\frac{\Delta H_{schm.}}{R} \cdot
\left[
\frac{1}{T} - \frac{1}{T_{schm.}}
\right]
=
\ln x_{A}](/pictures/dewiki/97/a0201f0adb7736eecc5b75330d38bdc2.png)
mit xA = 1 − xB und
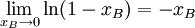 und T − Tschm. = ΔT erhält man die Gleichung
und T − Tschm. = ΔT erhält man die Gleichung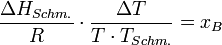
Ersatz von xB durch
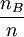 , wobei
, wobei 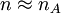 und
und 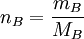 bzw.
bzw. 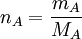 ist, führt bei Einführung von Molalitäten auf die folgenden Gleichungen (mit T · Ts ≈ T2s):
ist, führt bei Einführung von Molalitäten auf die folgenden Gleichungen (mit T · Ts ≈ T2s):
mit
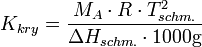
Durch Umformen der Gleichung kann man leicht die molare Masse des gelösten Stoffes aus der beobachteten Gefrierpunktserniedrigung bestimmen. Es gilt:
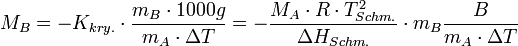
Anwendung
Die wohl wichtigste praktische Anwendung der Gefrierpunkterniedrigung gibt es im Winter, wenn Tausalz (Natriumchlorid) bei Minusgraden auf Eis- und Schneeflächen ausgebracht werden und der Aggregatzustand des gefrorenen Wassers sich von fest in flüssig umwandelt. Im chemischen Labor werden Eis-Kochsalz-Gemische oft als Kältemischung benutzt, das ist ebenfalls eine praxisnahe Anwendung der Gefrierpunktserniedrigung.
Aus der Gefrierpunkterniedrigung lässt sich die Molekularmasse des gelösten Stoffes bestimmen. Das Messverfahren hierzu bezeichnet man als Kryoskopie.
Diese Methode der Molmassenbestimmung fand vor allem früher breite Anwendung in der organischen und anorganischen Chemie, wenn es galt, die molare Massen neu-synthetisierter oder isolierter Verbindungen zu bestimmen. Dazu werden nach Möglichkeit Lösungsmittel ausgesucht, die eine große kryoskopische Konstante aufweisen.
Heutzutage kommen zur Molmassenbestimmung vor allem massenspektroskopische Verfahren zum Einsatz.
Siehe auch
Wikimedia Foundation.